抗肿瘤纳米药,如阿霉素脂质体“里葆多”,其作用就好像一个直达肿瘤的“包裹”,将药物比较特异性地运送病灶部位。但是,目前在临床上广泛使用的纳米药只是降低了药物引起的毒副作用,并没能够显著改善原药的疗效。这其中的原因之一是纳米药将药物输送到肿瘤,但并没有输送到每一个肿瘤细胞,这如同快递将包裹送到了小区的传达室、而未能送达用户手上一样。
如何让药物直接“快递”到家(肿瘤细胞)呢?近日浙江大学化学工程与生物工程学院申有青教授团队和加州大学洛杉矶分校顾臻教授团队合作,提出了纳米药在肿瘤组织中主动渗透新机制,来解决这一问题,使纳米药在实体瘤渗透到每一个角落、将抗肿瘤药物输送到每一个肿瘤细胞,并用多种动物模型验证了这种方法能够显著提高抗肿瘤疗效。
这项研究刊登在国际知名期刊《自然·纳米技术》(Nature Nanotechnology)上,论文第一作者为周泉、邵世群。
绕开“密林”为纳米药“改路”
治疗癌症的纳米药是将小分子抗肿瘤药负载到纳米尺寸的载体中得到的。纳米药的直径在10-100纳米,是小分子药的几十倍,可以说的上是名副其实的“大象级药”。相较于小分子药, 纳米药的优势在于注射到血液后可以躲过肾脏过滤,因而在血液中滞留较长时间而能更多地蓄积在肿瘤中。但它过于庞大的体积使其自身运动(扩散)能力很弱。与此同时,肿瘤内部缺少毛细血管网,有非常致密的细胞外基质和非常高的细胞密度,因此如此大体积的纳米药在细胞间穿行。因此,纳米药在肿瘤组织内的扩散,犹如一个大象在枝蔓横生的原始密林中一样难以前行。”申有青说。这就导致了纳米药即便能够积蓄在瘤内,也无法将携带的药物直接递送到每一个细胞内。
国内外学者针对这一问题做出了不少努力,包括降低肿瘤组织密度、减小纳米药尺寸等方法,来降低纳米药在瘤内的渗透阻力,但是这些工作并没有解决纳米药尺寸大、自身运动扩散能力弱、导致依靠自身扩散进行的瘤内被动渗透能力差的问题。
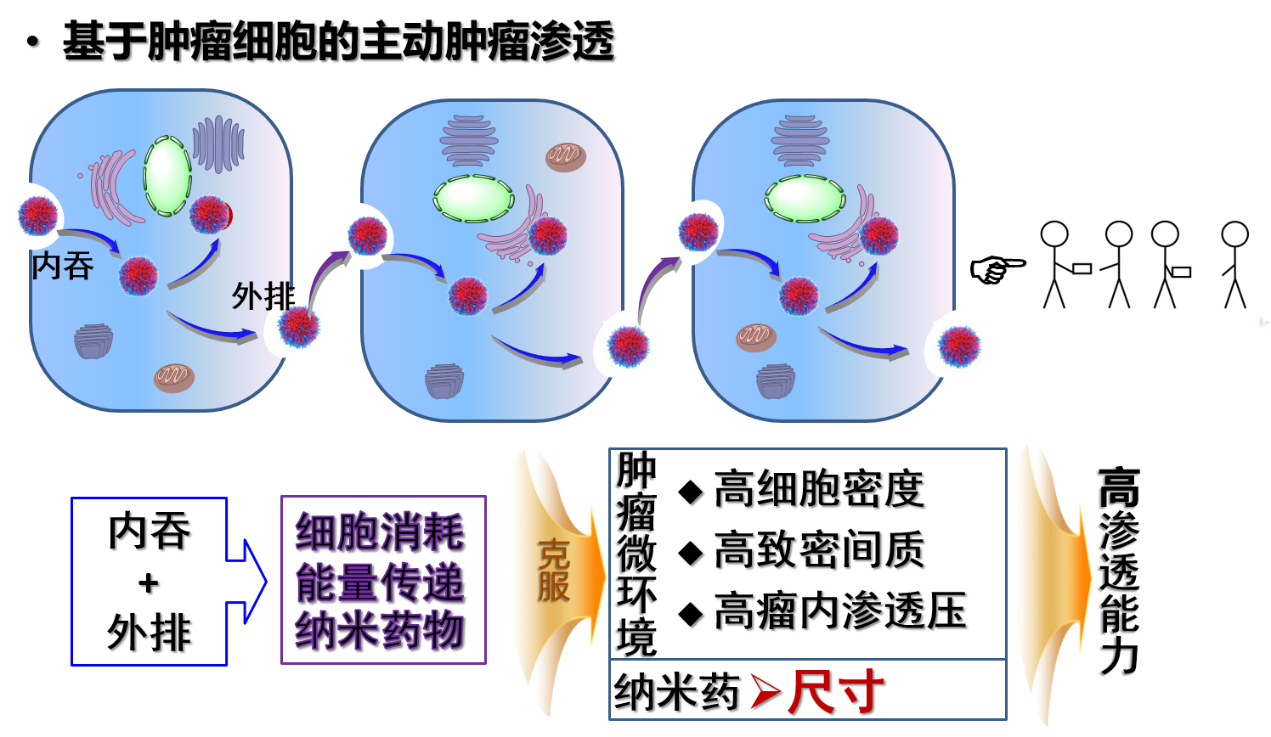
有没有可能发挥肿瘤细胞的“主动性”、让其“主动”地递送纳米药呢?这样既利用了瘤内高端细胞密度,又让纳米药直接在肿瘤细胞内穿行、绕开肿瘤细胞外基质这些“致密蔓藤”障碍。为此,申有青等设计了肿瘤细胞主动递送药物的方法:让肿瘤细胞一边吞噬纳米药,然后在另一边将一部分吐出来,这样循环往复,就将纳米药从肿瘤毛细血管处传递出去,到达每个肿瘤细胞。
这个过程的关键是细胞能够快速吞噬足够量的纳米药物,“细胞只有吃的够饱才会外排一些”。为此, 申有青等利用正负电荷相吸原理。“肿瘤细胞表面带负电荷,因此带正电荷的纳米药很容易地被吸附到细胞表面而被内吞”,申有青介绍。本工作的关键设计之一是纳米药在血液中是电中性的,只有在肿瘤血管或肿瘤细胞附进才带上正电荷,来触发快速细胞内吞和主动肿瘤渗透。触发电中性向正电性转化的开关则是肿瘤血管的内皮细胞上及血管附近肿瘤细胞过表达的γ-谷氨酰转肽酶(GGT)。科研人员利用GGT响应性的基团来遮蔽正电荷;在肿瘤内GGT酶将修饰物去掉,使其呈现正电性。
细胞内吞纳米药后,如何让其“慷慨地”吐出一些呢?申有青说这个所谓的外排环节,是细胞本身自带的功能。高尔基体是细胞中的重要分拣细胞器,就像是一个快递转运站,传递到高尔基体的物质会被打包外送出去。因此,本文的关键设计之二是通过控制纳米药结构使纳米药被吃进去后的去向是高尔基体,而不是其他细胞器。
积极的“主动渗透”带来高的疗效
在此次研究中,研究者还用多种动物模型考察了该新结构的纳米药,结果表明尾静脉注射的纳米药可以治愈体积为100立方毫米的小肿瘤,还能让500立方毫米的大肿瘤迅速萎缩变小。停药半个月后,未见反弹。并对具有癌症之王的“胰腺癌”,也有显著抑制肿瘤生长、延长了存活期的能力。
哈佛医学院的Hae Lin Jang 和Shiladitya Sengupta教授对该工作高度评价,认为该纳米药利用了细胞的转胞运机制获得了瘤内深度渗透,获得了高的疗效。
申有青表示,这种化被动渗透为主动的策略,使纳米药避开了肿瘤组织致密微环境构成的天然生物屏障,克服了纳米药大尺寸导致扩散能力低的天然缺陷,有望解决纳米药在肿瘤组织内渗透难的问题,为下一阶段纳米药物的设计开辟了新思路。
原文链接:https://www.nature.com/articles/s41565-019-0485-z
(柯溢能)



