近来,浙江大学张进团队在针对实体肿瘤治疗的iPSC来源的表达嵌合抗原受体的巨噬细胞(CAR-macrophage)研究工作上取得了数项重要成果。北京时间2023年11月27日,张进团队在Nature Immunology 上发表了题为“A second generation M1-polarized CAR macrophage with antitumor efficacy”的研究成果。该项工作设计了功能增强型的第二代诱导多能干细胞iPSC来源的工程化CAR-macrophage(CAR-iMAC),阐明了其抗原依赖性极化和激活,以及通过“胞葬”作用杀伤肿瘤的机制, 为CAR-iMAC应用于实体肿瘤的免疫细胞治疗提供了更加坚实的理论基础。

实体肿瘤的有效治一直是困扰医学界的重大难题之一。传统的手术切除、放疗和化疗治疗方式已经不能应付恶性程度较高的实体肿瘤。以CAR-T为代表的的免疫细胞疗法虽然在血液肿瘤中展现出理想的效果,但受限于肿瘤浸润能力差、容易耗竭等因素,其在实体肿瘤的治疗中显得捉襟见肘。因此,针对实体肿瘤的免疫细胞疗法也在呼唤更加“治之有效”的治疗产品。
巨噬细胞因其对异常细胞和病原微生物等抗原的免疫清除功能,以及抗原呈递和免疫调节方面的功能在体液免疫和细胞免疫过程中发挥着重要作用。研究发现,巨噬细胞占据某些类型实体肿瘤中浸润免疫细胞的40%以上,并对肿瘤微环境的塑造至关重要。因此,巨噬细胞成了针对实体肿瘤治疗研究的最新选择。然而,目前巨噬细胞应用于实体肿瘤的治疗依然面临着诸多难题,如:肿瘤微环境中易于被极化为促癌的M2状态;病人自体成熟巨噬细胞的基因编辑效率极低且制备周期长;治疗用细胞数量难以满足临床需求等。此外,如何赋予具有非特异性免疫功能的巨噬细胞靶向性抗肿瘤的能力继而增强其治疗效果,也是巨噬细胞抗实体肿瘤研究必须解决的问题。
基于以上问题,张进团队从如何赋予巨噬细胞可控的M1极化和激活,以及解决其可靠来源问题着手展开了研究工作。该团队首先基于一系列严格的筛选创造性地将具有极化和激活巨噬细胞功能的Toll 样受体4(TLR4)的胞内TIR信号转导结构域与第一代CAR中的CD3ζ信号结构域通过串联的形式构建到靶向特定抗原的CAR的胞内位置,继而构建了正交互补信号的第二代macrophage专属CAR。借助其成熟的iPSC分化巨噬细胞(iMAC)平台,团队分化得到了第二代CAR-iMAC。实验证实,第二代CAR-iMAC相对于单一信号的CAR-iMAC展现出了显著性增强的抗肿瘤功效。接受第二代CAR-iMAC治疗的8只肝细胞癌小鼠中的6只得到完全的肿瘤消除。胶质母细胞瘤(GBM)的荷瘤小鼠在治疗后的生存期也得到了显著性延长。进一步实验证实,该工程化免疫细胞在极大地提升了靶向抗肿瘤功效的同时,也分泌了更高水平的TNF等抗肿瘤因子,并展现出了可观的抗原呈递能力和更强的抵御肿瘤免疫抑制性微环境“裹挟”的能力。这一结果也意味着第二代CAR-iMAC在抗肿瘤过程中可以维持更高水平、更长时间的M1极化。单细胞测序结果证实与肿瘤细胞共培养的第二代CAR-iMAC实现了抗原依赖性的M1极化,呈现出典型的M1巨噬细胞表达谱。此外,在具有完整免疫系统的syngeneic荷瘤小鼠的抗肿瘤治疗中,研究人员发现G2-CAR-BMDM(小鼠版的第二代CAR-iMAC)在发挥自身抗肿瘤功效并维持M1极化的同时,充分调动了免疫微环境中的T细胞和NK细胞,实现了第二代CAR-iMAC促进实体肿瘤由“冷肿瘤”向“热肿瘤”转变的构想。
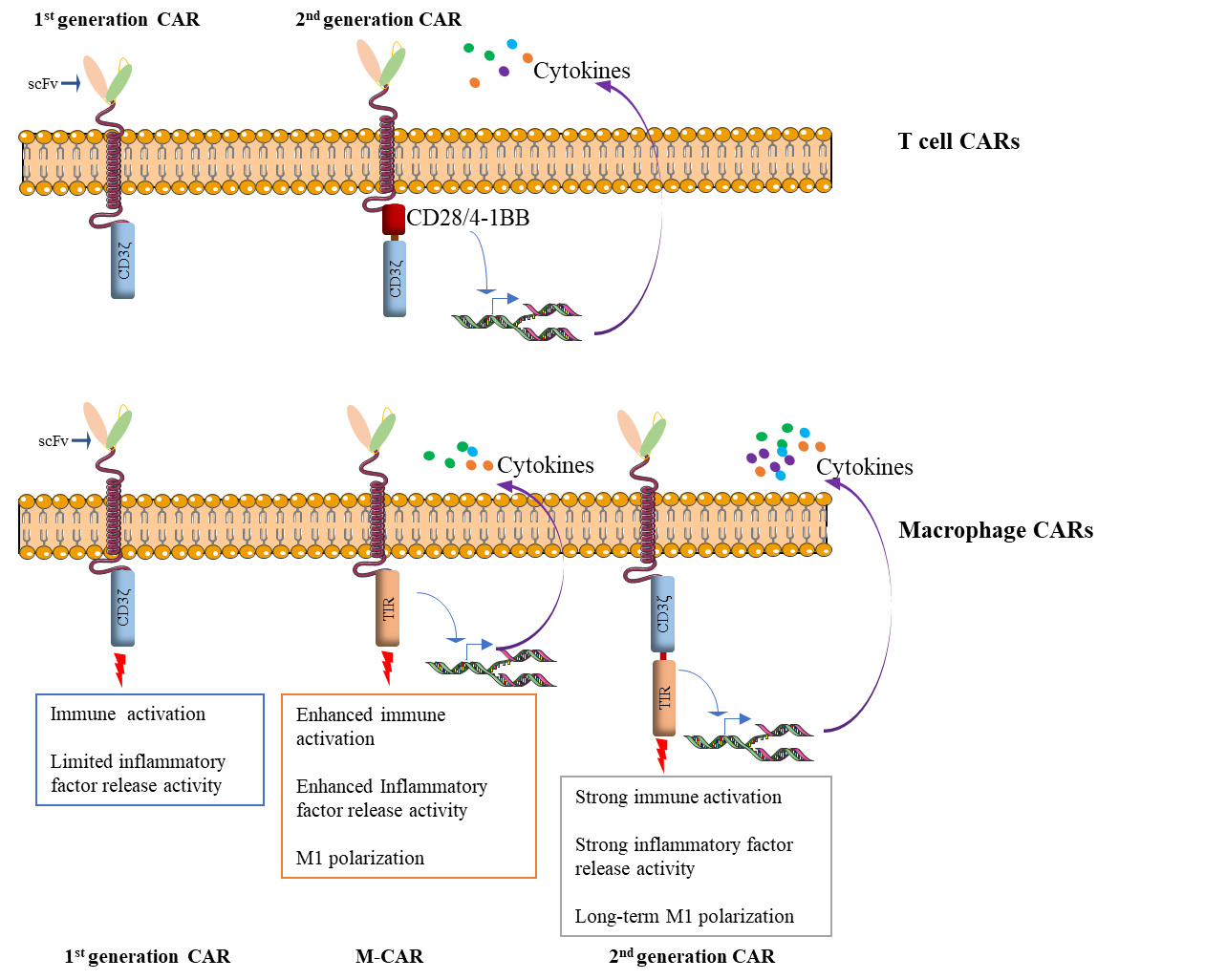
在机制上,该团队发现NF-κb/P65的核聚集介导了第二代CAR-iMAC的靶向M1极化和激活。阻止NF-κb/P65的入核显著性地抑制了该免疫细胞的靶向杀伤功能。这一工作也证明了引入TIR而构建的巨噬细胞专属CAR的合理性和可行性。同时,该项工作揭示了第二代CAR-iMAC对抗实体肿瘤的作用机制(mechanism of action or MOA),即通过诱导肿瘤细胞凋亡,而后清除凋亡小体的“胞葬(efferocytosis)”途径。
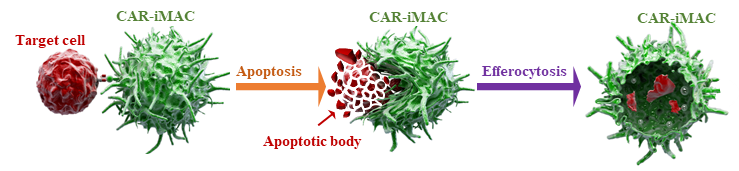
图2. 第二代CAR-iMAC通过“胞葬”作用清除肿瘤细胞。
该团队一直致力于iPSC来源的CAR-iMAC抗实体肿瘤的研究工作,并深耕积累,构建了一条系统性的研发路径。
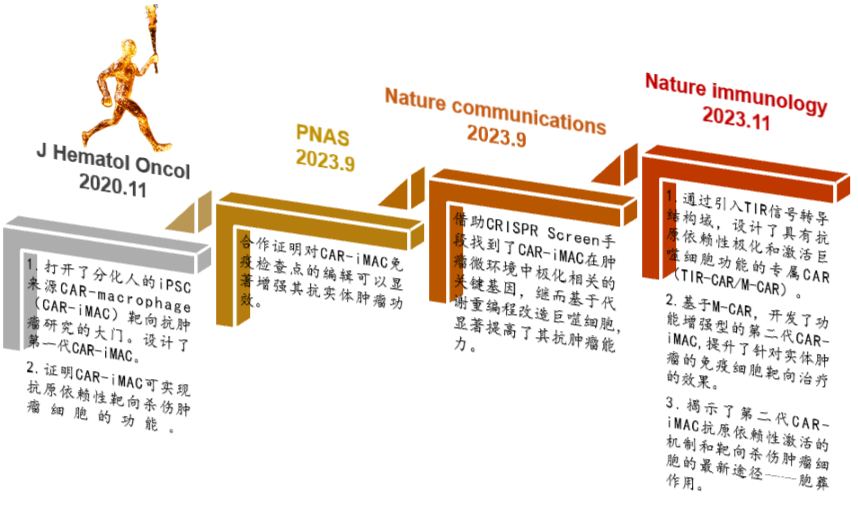
图3. iPSC来源的CAR-iMAC研究轨迹。
该团队在2020年11月就在J Hematol Oncol 上发表了题为“Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions”的研究成果。
2023年9月11日,该团队与浙江大学转化医学研究院/医学院附属第二医院王本课题组合作,在《美国国家科学院院刊》(PNAS)上发表了题为“Targeted glycan degradation potentiates cellular immunotherapy for solid tumors”的研究论文。同月,团队又在Nature communications上发表了题为“Metabolic Reprogramming via ACOD1 depletion enhances function of human induced pluripotent stem cell-derived CAR-macrophages in solid tumors”的研究性论文。
该二代CAR-iMAC研究的第一作者是浙江大学的雷安华,余华(现任南昌大学PI)是文章的共同第一作者。浙江大学的张进是该研究的通讯作者。研究受到了浙江大学陈家明教授、高志华教授、刘冲教授、刘志红院士、黄河教授,上海交通大学杨选明教授,哈佛大学George Church以及加州大学圣地亚哥分校Dan Kaufman与Huang Zhu的大力支持。
