核仁是多种液相凝聚物,存在液-液相分离(LLPS)现象,典型的核仁是一个三层区室化的结构,许多蛋白都定位于此并参与构建纤维中心(FC)、致密纤维组分(DFC)和颗粒组分(GC)液相分层。核仁相分离是核糖体生物发生,蛋白质的翻译和核仁应激反应所必需的至关重要的分子事件。然而,其在多能干细胞命运决定过程中的作用尚不清楚。LIN28A是一种高度保守的RNA结合蛋白,在促进体细胞重编程和多能性状态转变过程中发挥重要作用。细胞质中的LIN28A抑制let-7 microRNA的成熟在过去被广泛研究,但很少有研究关注LIN28A在细胞核中的作用。
2024年2月10日,浙江大学基础医学院干细胞与再生医学中心/浙江大学医学院附属第一医院/良渚实验室张进课题组,浙江大学基础医学院/浙江大学医学院附属邵逸夫医院冯钰课题组在Nature Communications杂志上发表题为“Dynamic nucleolar phase separation influenced by non-canonical function of LIN28A instructs pluripotent stem cell fate Decisions”的研究论文,本研究利用多种分子生物学实验首次发现LIN28A可以作为一个核仁完整性的标志蛋白,LIN28A的非经典相分离功能可以调控重编程,和帕金森症相关联的LIN28A IDR突变对核仁相变有重要作用。该研究与张进课题组在2021年7月31日Protein & Cell杂志上发表的题为“LIN28 Coordinately Promotes Nucleolar/Ribosomal Functions and Represses the 2C-like Transcriptional Program in Pluripotent Stem Cells”的研究论文以及2021年11月4日在Nature Communications杂志上发表题为“rRNA Biogenesis Regulates Mouse 2C-like State by 3D Structure Reorganization of Peri-Nucleolar Heterochromatin”的研究论文密切相关,并进一步从核仁应激和相分离角度,对核仁参与调控多能干细胞的命运决定的机制做出了更加深入的阐释。

首先,研究人员构建了eGFP-LIN28A敲入的小鼠胚胎干细胞E14细胞系和eGFP-LIN28A过表达小鼠胚胎干细胞E14细胞系。观察到LIN28A分布在细胞质和核仁, LIN28A与核仁颗粒组分(GC)层的NPM蛋白共定位,并包裹致密纤维组分(DFC)层的蛋白FBL。这说明核仁中的LIN28A蛋白可以作为核仁的标志物。同时,核仁中的LIN28A对相分离抑制剂1,6-己二醇(HEX)处理敏感, 1%HEX处理导致LIN28A凝集物在核仁内的面积明显扩张弥散,单位面积内荧光强度显著减弱,半径形状指数公式计算得到LIN28A形状的不规则度也显著增加(图1)。
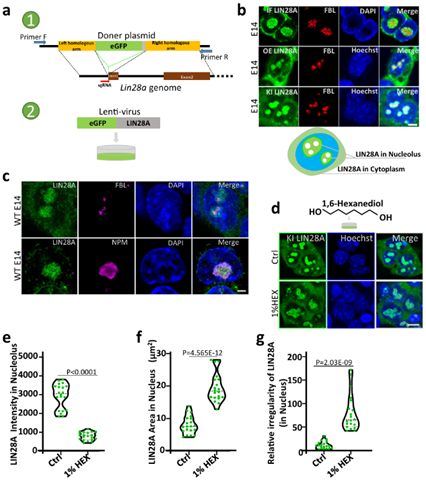
LIN28A在小鼠胚胎干细胞E14中的定位
在小鼠胚胎干细胞中,LIN28A的RNA结合结构域(RBD)和内在无序区(IDRs)是核仁相分离所必需的。LIN28A蛋白有五个主要结构域:N端序列(氨基酸1-38),使用常用的内在无序区评估网站PONDR(http://pondr.com/),预测N端序列为内在无序的区域(IDR1);一个冷休克结构域(CSD)和一个锌指结构域(ZFD),这两个结构域已被证明可以结合RNA,是典型的RNA结合区域;CSD和ZFD之间的柔性连接区域(Linker,氨基酸113-136),被预测为内在无序的区域,将其命名为IDR2;还有C端(氨基酸177-209)也被预测为无序区域,将其命名为IDR3。
为了确定LIN28A的单个结构域对核仁液-液相分离的贡献,研究人员构建了N端,C端,N+C端,CSD(氨基酸39-112)和ZFD(氨基酸137-176)单结构域缺失的截短体质粒。接着利用CRISPR/CAS9技术得到Lin28a敲除小鼠胚胎干细胞E14的单克隆,而后在Lin28a敲除细胞系中稳定表达FBL-mCherry或者NCL-eGFP融合蛋白,然后将对应的与eGFP, mCherry融合的截短体LIN28A表达到已经稳定表达FBL-mCherry融合蛋白的Lin28a敲除细胞系中。
实验结果发现,Lin28a敲除导致核仁被破坏,表现为FBL由野生型的环状变为弥散的状态。过表达全长LIN28A可以挽救FBL形态异常,使FBL和NCL重新恢复环状。LIN28A的 N端序列(IDR1)缺失,C端序列(IDR3)缺失或N,C两端序列同时缺失的截短体并不能拯救LIN28A敲除导致的核仁损伤,FBL仍然表现为异常的弥漫状态。CSD或ZFD的缺失严重破坏了LIN28A核仁定位和FBL环状形态,且LIN28A和FBL在核仁中的共定位异常。简而言之,当LIN28A的IDR或RBD被截断时,DFC层核仁蛋白FBL失去了它的“环”结构,这提示核仁相分离分层异常。对几种截短体细胞系中核仁蛋白FBL典型形态进行量化统计表明LIN28A的RNA结合区和内在无序区是维持核仁正常相分离所必需的。
此外,研究人员检测了FBL在以上几种LIN28A细胞系中的流动性,发现过表达全长LIN28A可以挽救Lin28a敲除导致的FBL流动性减弱的现象,而FBL在截短的LIN28A细胞系中都表现出相对较低的流动性。这一结果也从流动性的角度印证了LIN28A的RNA结合区和内在无序区是维持核仁正常相分离所必需的。
接下来,在体外实验中,研究人员纯化了全长和几种截短体LIN28A重组蛋白,发现只有全长的LIN28A蛋白可以形成液滴,任何IDR和RNA结合结构域的缺失都会消除LIN28A液-液相分离形成液滴的能力。LIN28A的N端序列缺失,CSD和ZFD之间的柔性连接区域缺失,C端序列缺失这三种IDR缺失情况会使蛋白形成不规则聚集体。
综上所述,LIN28A的IDR和RNA结合结构域对于形成LIN28A本身的相分离以及促进核仁蛋白相分离至关重要(图2)。
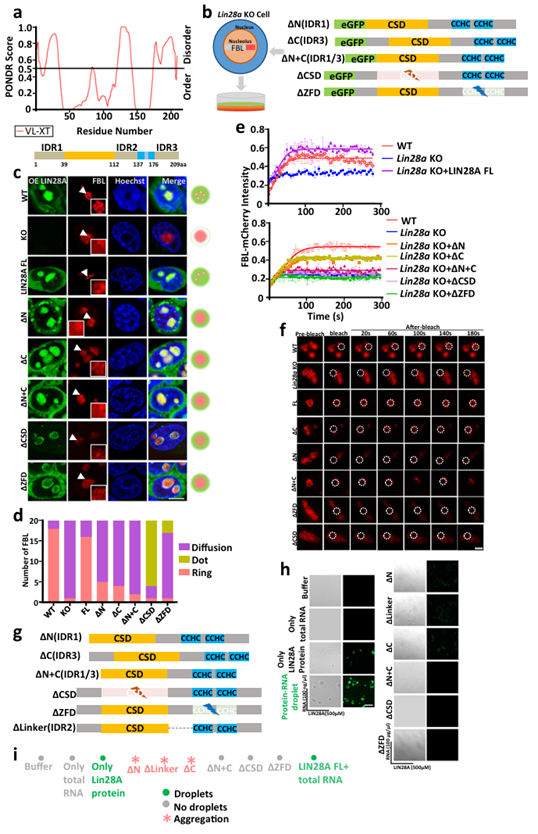
LIN28A的RNA结合结构域和IDRs是核仁相分离所必需的
IDRs的关键氨基酸对LIN28A和核仁相分离至关重要。上述的实验证明了RNA结合结构域和内在无序区对LIN28A和核仁的相分离至关重要。可以发生液-液相分离的蛋白的特点是IDR序列的存在。IDR区域富含少数氨基酸的重复序列,通常是低复杂度的区域,不折叠成一个固定的三维结构。RNA结合域已经在LIN28A功能的背景下进行了深入研究。作者更好奇IDR区域的功能,这是以前在LIN28A的研究中没有被关注到的。接下来,研究人员进一步将研究范围精确到到赋予IDR相分离特性所必需的关键氨基酸。可被磷酸化的S120, S200丝氨酸残基,以及与帕金森病相关的R192精氨酸残基,三者都在LIN28A的IDR区域中,并且这三个氨基酸在人和小鼠之间保守。一些研究表明,丝氨酸磷酸化和精氨酸通过改变蛋白所带电荷影响相分离。为了进一步了解这些氨基酸在LIN28A相分离中的作用,用丙氨酸取代丝氨酸,构建了模拟去磷酸化的 S120A和S200A双氨基酸突变的LIN28A突变体,命名为Mut LIN28A,并将该突变体稳定表达于Lin28a敲除的E14细胞系。FRAP实验结果表明,Mut LIN28A在核仁内的流动性减弱,并且导致核仁蛋白FBL流动性减弱。
而后,研究人员分别构建了模拟去磷酸化S120A LIN28A单个氨基酸突变体和模拟去磷酸化S200A LIN28A单个氨基酸突变体。FRAP分析显示,两个模拟去磷酸化的单个氨基酸突变体LIN28A蛋白都表现出较低的流动性,同时FBL在核仁中的流动性较低。
最近,功能丧失突变体R192G LIN28A在两个早发性帕金森病的病人中被发现,据报道,野生型LIN28A过表达可促进培养的神经干细胞在帕金森病模型中的治疗潜力,但在相分离领域里没有已知的机制解析突变导致的发育缺陷和中脑多巴胺神经元相关表型。FRAP分析显示,R192G单突变的LIN28A蛋白在核仁中的流动性较低,FBL蛋白也是如此。所有突变体在细胞质中的流动性不受影响。
为了进一步确认LIN28A突变体对核仁破坏作用是由于其相分离特性减弱所致,通过融合外源的FUS IDR (S120A-FUS IDR, S200A-FUS IDR, R192G-FUS IDR)来构建挽救性的LIN28A突变体, FUS IDR被公认可以驱动相分离。值得注意的是,融合的IDR恢复了LIN28A突变体的形态和相分离能力。
综上所述,IDR区域的关键氨基酸对于LIN28A相分离以及维持正常的核仁相分离是必需的(图3)。
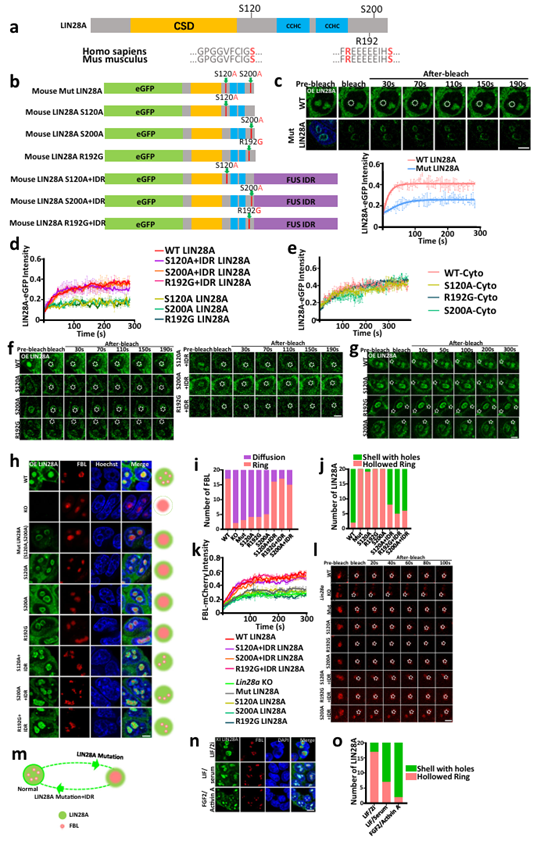
IDRs的关键氨基酸对LIN28A和核仁相分离至关重要
LIN28A维持的核仁相分离对小鼠胚胎干细胞从naive到primed多能性转化至关重要。与在LIF/2i培养条件中相比,FGF2/Activin A培养基培养的野生型mESCs表达较高的primed状态标志基因Otx2,Fgf5和Lin28a,较低的naïve状态标记基因Klf4、Nanog和Esrrb。在FGF2/Activin A培养基中培养的Lin28a敲除的mESCs,相对于野生型mESCs,表现出naïve状态相关基因Nanog,Klf4的持续高水平表达。在Lin28a敲除细胞中过表达全长野生型(WT) LIN28A时,FGF2/Activin A培养基中培养的细胞恢复了向primed状态转换的能力。这说明LIN28A可以促进mESCs从naive到primed多能性转化。
在Lin28a敲除细胞中过表达磷酸化缺失的LIN28A突变体(Mut LIN28A)时,NANOG免疫染色和荧光强度统计分析显示Mut LIN28A突变体细胞在FGF2/Activin A培养基中Nanog基因仍然持续高水平表达,倾向于维持naïve状态。磷酸化缺失的LIN28A (S120A和S200A)不能促进ESC从naïve状态退出,进入primed状态。S120A, S200A和R192G三个单氨基酸突变体LIN28A也都失去了促进mESCs从naïve状态退出,进入primed的功能,但是三种突变体与FUS IDR融合后,在FGF2/Activin A培养基中NANOG荧光减弱,mESCs可以顺利的进入primed状态。以上结果表明,LIN28A相分离对小鼠胚胎干细胞从naive到primed多能性转化至关重要。
STED超高分辨率成像显示,FBL在primed状态的野生型mESCs中形成了较大的典型的“环”结构,表明primed状态下的DFC单元更发达。LIN28A的缺失会导致FBL环状结构不明显,NPM形态异常,FBL不能浸润在NPM的小孔中,核仁分层紊乱。这种异常的FBL形态和核仁分层在从naive状态到primed状态的转换过程中没有改善。以上结果说明从naive状态到primed状态的转换过程中,LIN28A帮助核仁正确分层,维持核仁正常相分离。
综上所述,在naïve多能性状态向primed多能性状态转换期间,核仁的形态和功能变得更加成熟。LIN28A介导的相分离在核仁重构过程和随后的细胞命运的决定中发挥重要作用(图4)。
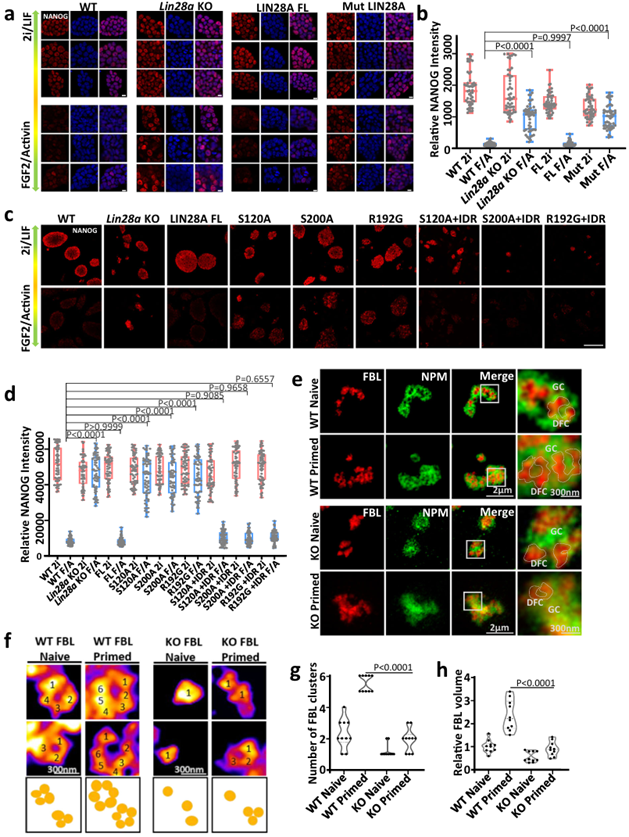
LIN28A维持的核仁相分离对小鼠胚胎干细胞从naive到primed多能性转化至关重要
LIN28A相分离对体细胞重编程至关重要。因此,研究人员想知道LIN28A在核仁中的相分离是否会影响重编程的效率。在小鼠体细胞重编程实验中,LIN28A IDR区单个氨基酸突变导致重编程效率降低。FUS IDR融合后的LIN28A突变体挽救了降低的重编程效率,其具备与野生型相似的重编程效率。
作者进一步鉴定了小鼠的MEF细胞和iPSCs的核仁状态,STED成像显示MEF细胞和小鼠iPSCs之间核仁的形态和分层存在显著差异。在MEF细胞中,NPM呈不规则形状;而在iPSCs中,NPM呈圆形带小孔的“莲藕”结构,并与LIN28A共定位。使用半径指数公式 (Boyce-Clark semidiameter index)来量化GC层形状的规律性。与MEF细胞相比,在iPSCs中,GC层形态显示更高程度的规则性。
综上所述,在小鼠体细胞重编程的研究背景下, IDR区域介导的LIN28A相分离对小鼠体细胞重编程过程中的核仁重塑至关重要,并关系着重编程的效率。重编程的过程也是核仁分层变得清晰的过程(图5)。
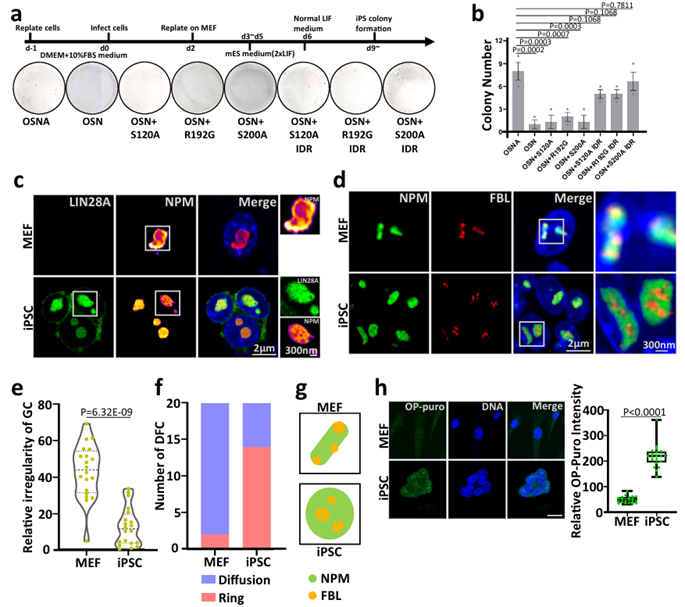
LIN28A相分离对体细胞重编程至关重要
综上所述,该研究明确了LIN28A帮助完善核仁分层,这在小鼠胚胎干细胞从naive到primed多能性转化过程中起到促进作用;以及在重编程体系中LIN28A相分离对核仁重塑,进而促进重编程的作用(图6)。
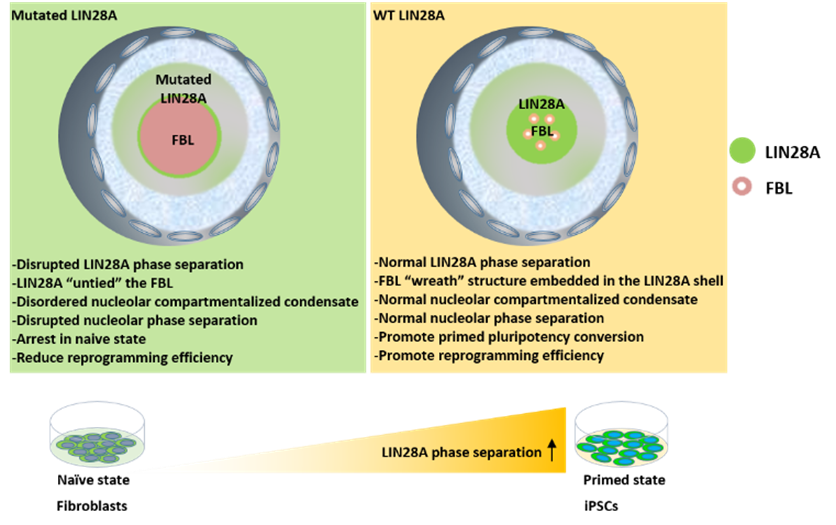
LIN28A相分离在维持核仁完整性和决定细胞命运中的作用模型
浙江大学张进教授和冯钰教授为本文的通讯作者。浙江大学医学院博士生谭田雨为本文的第一作者,浙江大学医学院博士生高波为本文提供大力帮助。本课题的研究得到了国家重点研发计划、国家自然科学基金面上项目、国家自然科学基金青年基金项目、浙江省杰出青年基金项目以及浙江省自然科学基金项目的支持,同时还得到了浙江大学尹亚飞课题组,浙江大学钱鹏旭课题组,北京大学季雄课题组,哈佛医学院George Daley课题组等国内外单位的支持。



