单细胞多组学(Single-cell multi-omics)技术是在单细胞单组学技术的基础上,实现在同一细胞中测量多种组学数据的前沿技术,Nature Methods杂志和中国科协曾将其列为2019年年度技术和20个重大科学问题及工程技术难题之一。单细胞多组学技术可以在单一细胞个体内,同时分析多个基因、蛋白质和小分子的表达情况,从而更全面地揭示细胞的状态和功能,有利于从遗传信息、信号调控、蛋白表达、代谢通路等多层面探究生命活动的奥秘以及疾病的发生、发展与治疗机制。蛋白质作为细胞生命活动的执行者,直接反映了细胞真实的生命活动状态,因此,发展包括单细胞蛋白质组的多组学分析技术具有非常重要的意义。
自2021年,浙江大学化学系方群教授团队与浙江大学良渚实验室王永成团队和傅旭东团队合作,基于微流控纳升级超微量样品操作技术、深度单细胞蛋白质组分析技术和单细胞转录组测序技术,发展了单细胞同时转录组和蛋白质组(Single-cell simultaneous transcriptome and proteome, scSTAP)分析技术,首次实现针对同一单细胞个体转录组和蛋白质组深度联合定量分析。近日,相关成果在Cell Reports期刊上以“Simultaneous deep transcriptome and proteome profiling in a single mouse oocyte”为题在线发表(https://doi.org/10.1016/j.celrep.2023.113455)。
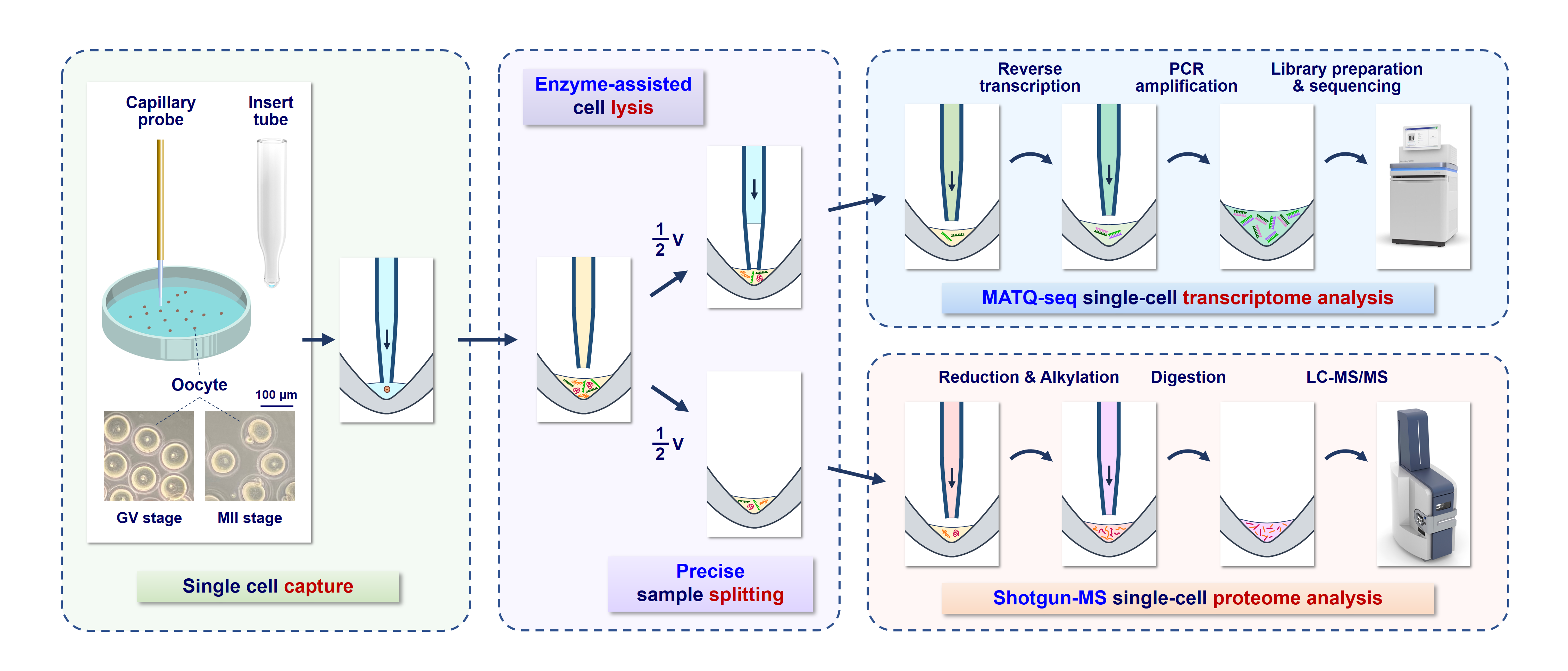
图1 scSTAP单细胞多组学分析技术流程示意图
在单细胞中,核酸、蛋白质和代谢物等生命物质的含量极其微少,如在单个哺乳动物体细胞中含有的各类蛋白质总量一般只有200皮克(10-12 g)左右。目前,基于核酸标记抗体法的CITE-seq等相关技术在单细胞转录组与蛋白质组分析中实现了应用的突破。然而,这种基于抗体的靶向蛋白质分析方法往往只能分析数十种至近百种靶向的蛋白质,在鉴定深度上受到抗体种类数量的影响,使其在生物医学研究中的应用受到限制。
方群团队前期发展了序控液滴(SODA)微流控技术,能自动地完成对超微量(纳升-皮升级)液滴的复杂操控,尤其擅长进行多步骤的超微量样品预处理和分析。针对单细胞多组学分析中存在的难点问题,团队发展了基于SODA纳升级液滴精准分样的单细胞多组学分析策略,同时,为解决转录组与蛋白组分析的兼容性问题,发展了两步法细胞裂解方法,由此建立了scSTAP分析技术和平台。其操作流程是:在纳升级体系内,将单细胞裂解形成均匀裂解液,并采用液滴分裂技术将液滴均匀分成两份,分别用于基于质谱的单细胞蛋白质组分析和单细胞转录组测序分析,从而实现同一单细胞个体中转录组和蛋白质组的同时分析(图1)。
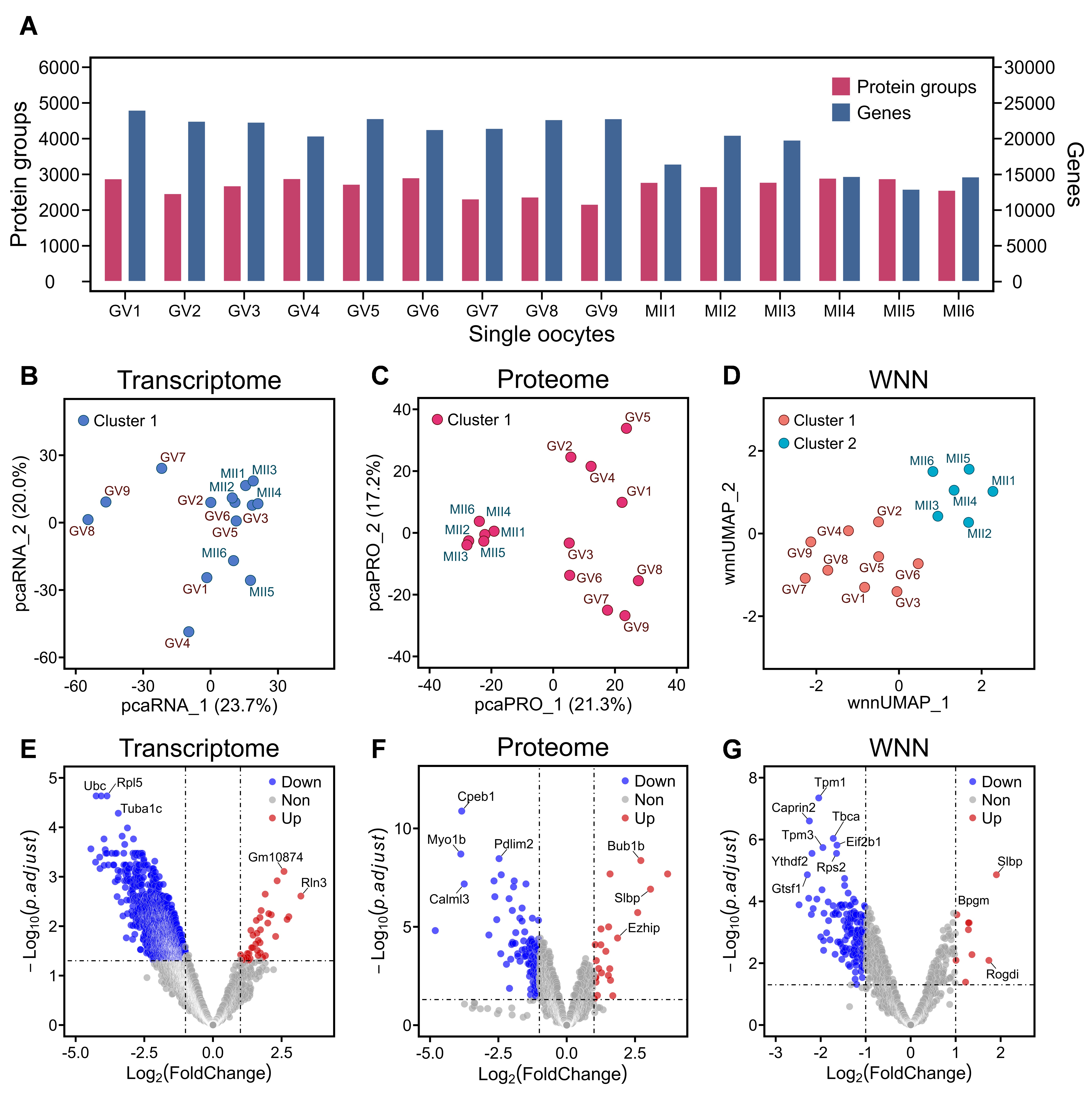
scSTAP分析平台被应用于减数分裂前后鼠卵单细胞的多组学分析,首次实现了同一单个鼠卵细胞的转录组与蛋白组同时分析,在GV期和MII期单个鼠卵细胞样品中达到了19948个基因和2663个蛋白质组的平均定量水平。在不同时期卵细胞间转录与蛋白的差异表达研究中,鉴定出2392个差异表达转录本和127个差异表达蛋白质(图2)。
基于scSTAP平台,还进一步分析了卵母细胞减数分裂过程中的转录组和蛋白质组的表达相关性。研究表明,转录组与蛋白质组的整体表达相关性较弱,其中,少部分基因(n = 44)在转录和蛋白质表达水平上具有良好的正相关性,主要参与蛋白质翻译的调控与mRNA代谢过程。有趣的是,个别基因在转录和蛋白质表达水平上具有负相关性,且采用Western blotting技术验证了其蛋白质表达的上下调情况的可靠性。上述结果为后续的转录组和蛋白质组相关性研究提供了重要的启示和可靠的数据基础。
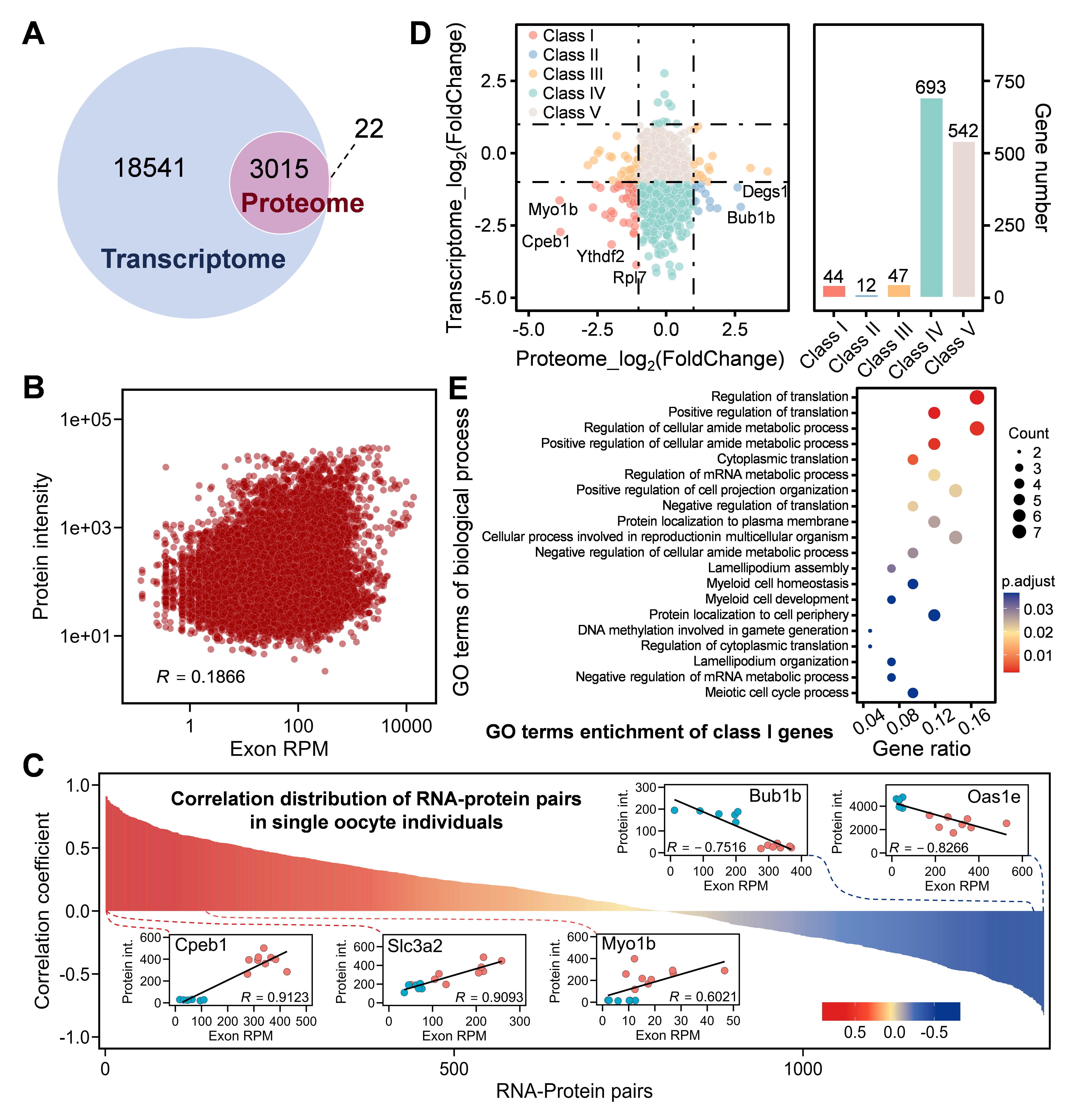
图3 卵母细胞减数分裂过程中转录组和蛋白质组的表达相关性分析
scSTAP技术的开发为实现基于单细胞蛋白质组学的多组学技术在分析深度上的突破提供了新的解决方案,对未来围绕单细胞蛋白质组技术开发单细胞三组学甚至单细胞全组学技术提供了有力的技术基础。
本文共同第一作者为浙江大学化学系博士生蒋易蓉、浙江大学良渚实验室博士后朱乐、曹兰蕊和浙江大学化学系博士生吴琼,共同通讯作者为浙江大学化学系方群教授、浙江大学良渚实验室王永成研究员和傅旭东研究员。该项目获得国家自然科学基金和科技部等项目的资助。



