机械转导(mechanotransduction)参与众多基本生理过程,包括听觉、触觉、本体感觉、疼痛、血压调节和眼压调控等。在分子水平上,机械门控通道(mechano-gated channel)作为机械力感受器,将机械力转换为神经电信号,实现机械信号的转导。目前动物界已经发现的机械门控通道都是阳离子通道或者阳离子可通透的通道(如Piezo1/2、TMC1、TRP-4/NomPC/TRPN、ENaC和K2P),未报道有机械门控的阴离子通道存在。
2025年2月16日,浙江大学医学院脑科学与脑医学学院康利军教授团队在Nature Communications上发表了题为“Anoctamin-1 is a core component of a mechanosensory anion channel complex in C. elegans”的研究论文。他们发现,钙激活的氯离子通道Anoctamin-1(ANOH-1)介导通过直接感受机械力,编码雄性秀丽线虫的触觉感受。人源ANO1/TMEM16A具有类似的机械敏感特性。而且,ANOH-1/ANO1对机械刺激的感受,需要CIB2和ankrin等辅助分子1。该工作揭示了氯通道在机械刺激感受中的功能和分子机理,并为感知觉异常相关疾病研究和药物开发奠定了科学基础。

在前期工作中,康利军教授团队发现贝多芬基因tmc1具有多模态功能,并解析了其作用机制,提出了TMC1作为机械门控阳离子通道介导听觉的双栓系模型(Neuron 2018, 2021, 2024)2-4。利用分子遗传学、活体钙成像、膜片钳电生理、药理和行为学分析等方法,本研究中,团队发现钙激活的氯离子通道ANOH-1参与雄性线虫的触觉响应,药理学和电生理记录表明ANOH-1直接介导了机械受体电流,而且其哺乳动物同源基因ANO1具有类似功能。通过基因筛选和Co-IP等实验,团队进一步发现ANO1/ANOH-1的机械力感受需要CIB2和Ankrin等辅助分子的参与1。有意思的是,CIB2和Ankrin等分子也是在内耳听毛细胞中TMC1阳离子通道感受机械力所需要的辅助分子(图2)。这项工作,连同团队前期研究,揭示了听觉、触觉等机械性感受的基本机理,为感觉障碍相关疾病的研究和药物开发奠定了科学基础。。
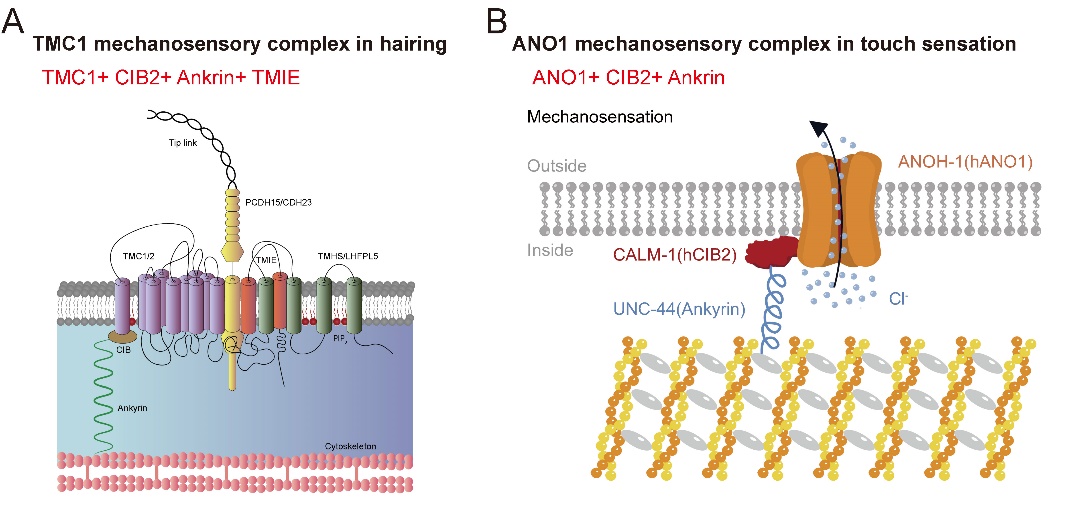
图:TMC1和ANO1机械感受复合体模式图。(Neuron 2021, 2024; Nature Communication 2025)
浙江大学医学院附属第一医院研究员邹文娟为本研究第一作者及共同通讯作者,浙江大学医学院脑科学与脑医学学院博士后范月丹、博士生刘佳、浙江大学医学院附属第四医院博士后程汉奎为共同第一作者;浙江大学医学院脑科学与脑医学学院、浙江大学医学院附属第四医院康利军教授为最后通讯作者。浙江大学医学院附属第一医院郑秀珏、詹仁雅和王峰主任医师、浙江大学医学院附属第四医院张永明和赵国华主任医师和复旦大学脑科学研究所唐逸泉教授等参与了本课题的工作。浙江大学医学院附属第四医院孙启明教授和雷璟博士为本研究中Co-IP实验给予了技术指导。本研究受到国家自然科学基金、浙江省自然科学基金、国家科技部科技创新2030-“脑科学与类脑研究”重大项目等资助,得到浙江大学医学院附属第一医院和浙江大学医学院公共技术平台的大力支持。
参考文献:
1Zou, W. et al. Anoctamin-1 is a core component of a mechanosensory anion channel complex in C. elegans. Nature communications16, 1680, doi:10.1038/s41467-025-56938-z (2025).
2Jiang, Q. et al. Sequence variations and accessory proteins adapt TMC functions to distinct sensory modalities. Neuron112, 2922-2937 e2928, doi:10.1016/j.neuron.2024.06.013 (2024).
3Al-Sheikh, U. & Kang, L. Molecular Crux of Hair Cell Mechanotransduction Machinery. Neuron107, 404-406, doi:10.1016/j.neuron.2020.07.007 (2020).
4Yue, X. et al. TMC Proteins Modulate Egg Laying and Membrane Excitability through a Background Leak Conductance in C. elegans. Neuron97, 571-585 e575, doi:10.1016/j.neuron.2017.12.041 (2018).



