在哺乳动物中,以TRP离子通道为代表的感受器蛋白质能够迅速感受外界温度、化学刺激等变化,将环境信号转化为生物电信号并使得动物做出相应的行为去适应环境变化。但是,TRP通道如何被温度激活的机制仍然未知。另一方面,很多较低等的动物(如多足类动物蜈蚣等)也能感知环境刺激。因此,研究低等动物的温度感受机制可能有助于理解哺乳动物的温度感受。
此前东北林业大学杨仕隆团队与杨帆团队合作(PNAS,2023),在蜈蚣触须中发现了一种宽域温度敏感受体1(Broad-range thermal receptor 1,BRTNaC1)。该受体能够感受由光能转化的热能,并引发蜈蚣的避光行为(图1)。在膜片钳电生理实验中, BRTNaC1表现出对热和胞外酸化的响应。然而, BRTNaC1的热激活机制是什么,与经典的TRP通道有无相似之处,及其配体调控的分子机制,均有待进一步研究。
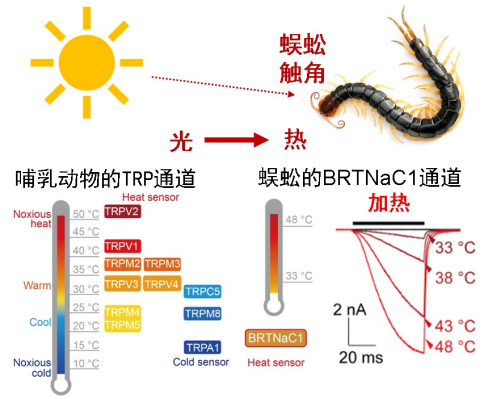
图1. BRTNaC1通道是新型热感受器离子通道。
2025年2月26日,浙江大学基础医学院生物物理系/良渚实验室/附属第一医院的杨帆团队联合浙江大学医学院附属第四医院/“一带一路”国际医学院/国际健康研究院苏楠楠研究员团队、东北林业大学杨仕隆教授团队在Nature Structural & Molecular Biology杂志上发表了题为“Structure and function of a broad-range thermal receptor in myriapods”的研究论文,揭示了BRTNaC1通道的质子激活和热激活机制。

该研究显示,BRTNaC1是一个同源三聚体离子通道,每个亚基包含两个跨膜螺旋区和一个较大的胞外域,其整体结构与ASIC家族通道的其他成员相似。跨膜螺旋2(TM2)有一个GIC基序,类似于ASIC通道中的GAS基序,将TM2 α螺旋分成上下两部分TM2a和TM2b。GIC基序横跨两个亚基,使得TM2b与相邻亚基TM1结构域相互作用,从而稳定跨膜区结构。
使用膜片钳电生理进行记录时,研究人员发现BRTNaC1可以被胞外质子浓度依赖性地激活。同时,研究人员解析了BRTNaC1分别在pH8(3.1 Å)和pH4(3.1 Å)两种状态下的冷冻电镜结构。结合分子动力学模拟结构显示,在低pH条件下,通道的胞外域与跨膜螺旋区之间的连接子结构发生扭转,跨膜区螺旋逆时针旋转,从而打开通道。在此过程中,一对带相反电荷的氨基酸D80和R384在低pH下因质子化,破坏了这对氨基酸的静电相互作用,使得通道处于更容易打开的结构状态。
为探究热激活机制,研究者解析了BRTNaC1在4℃和40℃状态下的三维结构。结果显示,在40℃时,通道发生显著的构象变化,包括跨膜区逆时针旋转3.9°并向上移动2.1Å,这导致通道孔径扩大,使离子和水分子能够通过。之一发现揭示了BRTNaC1的热激活是通过引发跨膜结构域的广泛构象变化来直接开启离子通道。
而温度是如何被离子通道蛋白质所感受?杨帆团队此前在低温感受器TRPM8上,发现如果增加发生了从包埋到暴露的构象变化的氨基酸位点的侧链疏水性,则可以增大其温度敏感性(PNAS,2020)。BRTNaC1的D217和E218位点发生了从包埋到暴露构象变化,所以如果BRTNaC1通道感受热的机制相似,那么在热激活BRTNaC1上,降低D217和E218这两个位点的氨基酸侧链疏水性,同样可以实现增加该通道的温度敏感性。通过点突变和膜片钳电生理实验,确实观察到了这样的现象(图2)。

图2. BRTNaC1通道的热激活机制。
总之,该研究验证了杨帆团队提出的关键氨基酸包埋/暴露动态构象变化介导离子通道温度感受的机制,不仅在TRPM8等哺乳动物的温度感受器上适用,在低等动物的热感受器BRTNaC1上同样适用,为最终理解生命体对温度的感知打下了坚实基础。
浙江大学良渚实验室博士后陈晓莹、东北林业大学野生动物与自然保护地学院博士生袁立成和深势科技温翰博士为该工作的共同第一作者。杨帆长聘副教授、苏楠楠研究员和杨仕隆教授为本文的共同通讯作者。本研究得到国家自然科学基金、浙江省自然科学基金和中国博士后科学基金的资助,也得到了浙江大学冷冻电镜中心常圣海、武灵云、马骋等老师的帮助。
原文链接:
https://www.nature.com/articles/s41594-025-01495-8
参考文献
Yao, Z. et al. A thermal receptor for nonvisual sunlight detection in myriapods. Proceedings of the National Academy of Sciences of the United States of America 120, e2218948120, doi:10.1073/pnas.2218948120 (2023).
Yang, S. et al. A paradigm of thermal adaptation in penguins and elephants by tuning cold activation in TRPM8. Proceedings of the National Academy of Sciences of the United States of America 117, 8633-8638, doi:10.1073/pnas.1922714117 (2020).



