T细胞受体(T cell receptor, TCR)介导的抗原特异性识别是适应性免疫应答的核心,其精准区分自我与非我抗原的能力对肿瘤免疫监视至关重要。传统观点认为,经工程化改造的高亲和力TCR可增强抗肿瘤效果,但相关临床试验发现,这类改造后的TCR常常伴随着对自我抗原的交叉反应而引发脱靶毒性,这一问题严重阻碍了TCR-T等细胞疗法的临床转化应用。
浙江大学基础医学院陈伟团队、生物医学工程与仪器学院尹巍巍团队与中国科学院生物物理所娄继忠团队合作研究揭示:天然TCR通过柔性界面与抗原形成动态逆锁键(catch bond),在生理拉力的作用下,触发pMHC构象变化;该力学柔性赋予天然TCR选择性地调控辅受体CD8的构象及其与pMHC的结合能力,进而特异性地增强TCR对抗原的区分能力。然而,工程化高亲和力TCR因刚性结合界面破坏了这种力学柔性以及CD8的调控选择性,反而容易与非目标抗原稳定结合,产生脱靶毒性。基于这一研究结果,团队构建了力学-化学耦合调控的互作动力学特征与TCR功能关联映射模型,为设计高特异性TCR-T肿瘤免疫疗法提供了全新理论框架和量化评价工具。该成果不仅阐明了辅受体CD8在天然TCR特异性识别中的关键作用和全新的调控机制,更为新一代高特异性TCR工程化设计提供了力学量化评价体系,为破解T细胞治疗中精准度与安全性难以兼顾的难题提供了关键理论支撑。
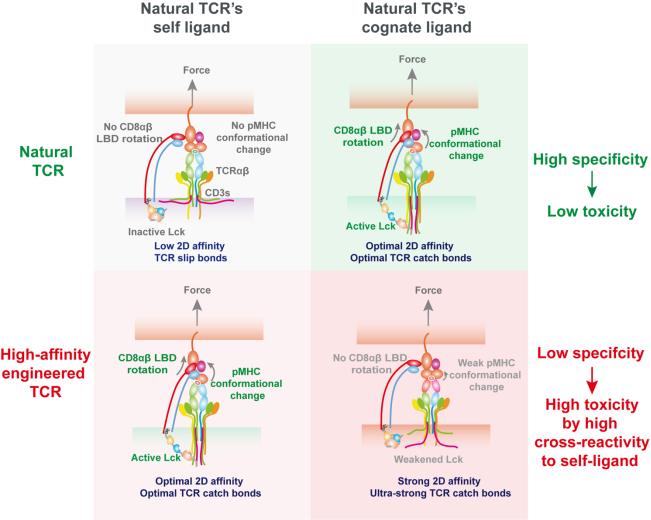
逆锁键非线性协同CD8塑造TCR抗原识别的特异性的模式图
浙江大学医学院/良渚实验室博士后秦瑞为本文的第一作者,浙江大学生仪学院施佳未博士、中科院生物物理所张宏博士、郑州大学武鹏博士为本文的共同一作,浙江大学医学院/良渚实验室陈伟教授、生仪学院尹巍巍副教授、中科院生物物理所娄继忠研究员为共同通讯作者。本研究得到了中科大李小龙教授团队的大力支持;得到了国家自然科学基金交叉学部(T2394511)等项目的大力支持支持。
原文链接:
https://www.nature.com/articles/s41422-025-01077-9



