质子作为生命活动的核心调控者之一,生命已进化出了多种生物传感器感知胞内外的质子浓度变化,其中就包括了感知胞外pH的质子感应G蛋白偶联受体(Proton-sensing G protein coupled receptors,Proton-sensing GPCRs)。
在众多胞外pH传感器中,质子感应GPCR因其广泛的组织分布和多样的生物学功能成为研究焦点,包括GPR4、GPR65(TDAG8)、GPR68(OGR1)等。这些受体在人体中广泛表达,具有重要的生理功能。其中,GPR4在多种组织细胞中广泛表达,如内皮细胞、肾脏、胃肠道和免疫细胞,在调节血管生成、血压和炎症反应中扮演了重要的角色;GPR65和GPR68则表达于多种组织的免疫细胞中,在免疫调节、炎症反应和细胞增殖中发挥重要作用。
GPR4的功能失调与多种疾病的发生和发展密切相关,尤其在炎症和肿瘤病理过程中扮演着重要角色。在炎症方面,GPR4的过度激活加剧骨关节炎等炎症反应;而拮抗GPR4能够有效缓解肠道炎症,为炎症性疾病的治疗提供新的思路。在肿瘤病理方面,GPR4在肿瘤组织中的过表达具有显著的促癌性,提示其在肿瘤发展中的潜在作用。因此,靶向GPR4的拮抗剂研发具有广阔的应用前景。然而,目前已知的GPR4拮抗剂分子在病理条件下的酸性环境中,其拮抗效应会受到限制。因此,深入研究质子感应GPCR的信号识别、激活以及小分子拮抗机制是十分必要的。通过对GPR4质子感应以及激活机制的深入探索,不仅有助于揭示其在健康和疾病中的复杂作用,还可以为开发更高效的GPR4拮抗剂奠定分子基础。
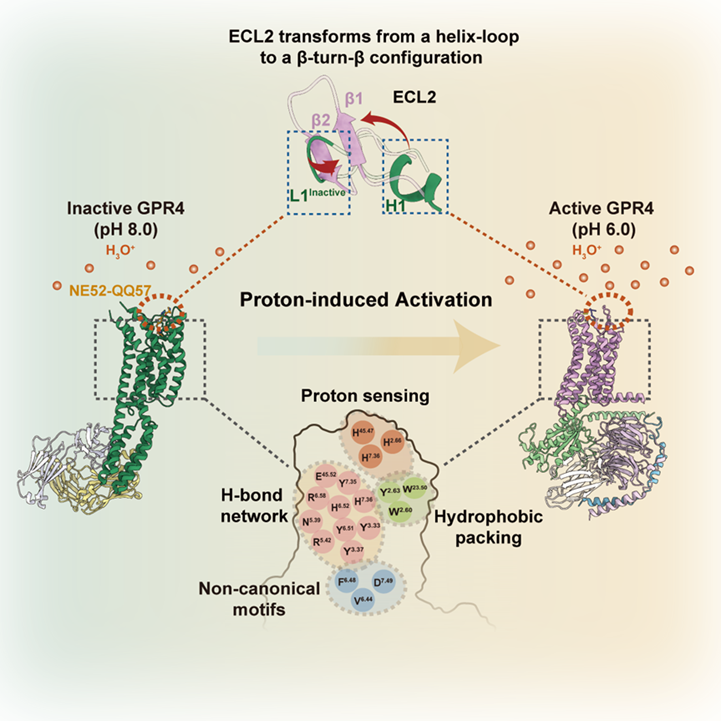
2025年4月10日,浙江大学医学院张岩/毛春友团队、浙江大学医学院附属邵逸夫医院蔡秀军团队与南京医科大学药学院韩峰团队,在Molecular Cell上发表了题为Proton perception and activation of a proton-sensing GPCR的研究论文。该研究解析了典型质子感应受体GPR4于激活态(偶联Gs/Gi蛋白)与非激活态(未结合配体的/结合拮抗剂NE52-QQ47的)下的高分辨率三维结构,揭示了该受体响应质子激活的原子密码。该研究揭示组氨酸残基能作为“质子传感器”,触发ECL2从螺旋-环到β-转角-β的二级拓扑结构转变,从而驱动跨膜结构域重排以及G蛋白口袋的打开。此外该研究还阐明了拮抗剂NE52-QQ57阻断GPR4激活的机制,为靶向肿瘤、炎症等相关疾病的药物设计奠定了结构基础。
GPR4的质子感知及激活的结构机制图
解析质子感应GPCR激活机制的挑战
由于质子感应GPCR的高度动态性和质子传递的瞬时性,单一传统的生物学实验技术难以鉴定其变化的过程,阻碍了人们对质子感应GPCR激活机制的了解。此外,非激活态结构信息和激活过程中信息的缺失也对解析质子感应GPCR激活机制造成了挑战。首先,非激活态高分辨率结构的缺乏使得人们难以观察受体激活前的构象以及质子结合后关键位点的变化,从而限制了对其在结合质子后进行信号转导的理解。其次,激活过程中质子结合信息的传递、受体构象重排以及G蛋白结合模式等细节信息的缺失,也阻碍了对激活路径的完整描绘。这些信息的不足使得质子感应GPCR的功能与结构之间的关联性难以明确,增加了揭示其激活机制的难度。
多技术手段协助解析质子感知密码
本研究通过多技术手段协助解析了质子感应GPCR——GPR4质子感知及激活机制。首先,本工作利用前期课题组联合开发的Nanobit黏连技术稳定激活态GPR4与不同G蛋白的复合物构象,同时基于人工智能优化非激活态下GPR4与辅助结构解析标记蛋白BRIL之间的连接子序列,最终完成GPR4质子感应与激活过程中四种不同状态的高分辨率三维结构解析,进而揭示了受体构象显著变化及感应质子的关键区域。之后,通过功能实验鉴定关键区域中负责质子感应的残基,从而验证了结构分析的结果。此外,研究人员通过自动化路径优化算法TAPS在终端状态已知的情况下动态模拟了质子结合后受体的构象重排过程,揭示了质子感应的关键残基和激活的传递路径。此外,基于高分辨结构和恒定pH模拟计算的pKa结果为关键残基质子化状态提供了理论支持。这些多技术手段的综合运用,最终揭示了GPR4感知质子和激活的精细机制,也阐明了pH变化调控GPR4的活性的分子基础。
这项工作解析了质子感应GPCR(GPR4)信号转导全周期的结构图谱,包括其未结合配体的非激活态、结合拮抗剂NE52-QQ57的非激活态,与Gs偶联的激活态以及与Gi偶联的激活态。通过结合结构分析、功能实验、自动化路径优化模拟和基于结构的pKa计算,阐述了三个胞外组氨酸残基H79、H165和H269对于GPR4质子感知的作用。本研究进一步揭示了在质子诱导的激活后,GPR4胞外环经历显著构象变化,特别是ECL2从非激活状态时的螺旋-环构象转变为了激活状态下的β-转角-β构象。ECL2的构象变化被疏水核心和氢键网络进一步向胞内传导并最终触发胞内G蛋白口袋的开启。需要指出的是,研究发现拮抗剂NE52-QQ57仅能在低质子浓度下部分抑制上述ECL2构象变化,而在高质子浓度下失能,暗示该类质子拮抗剂临床开发存在局限性。该工作加强了对质子感应GPCR的质子感知和激活分子机制的全面理解,并促进了未来靶向质子感应GPCR的药物设计研究。
正如论文第一作者陈礼楠博士所言:“每一个受体的激活,都是生命与环境的对话。这些精妙的分子机器携带着专属的激活密码本,我们正在破译这些分子密码,进而设计创新干预密钥,突破现有调控手段的局限性。”
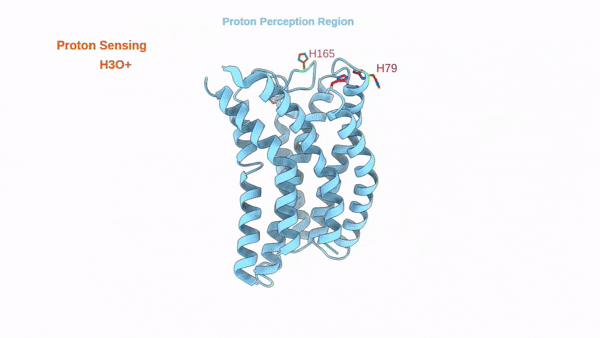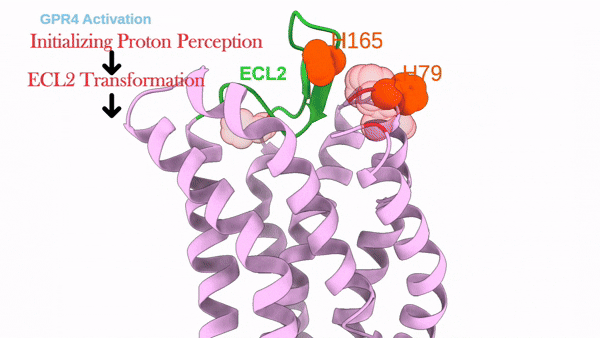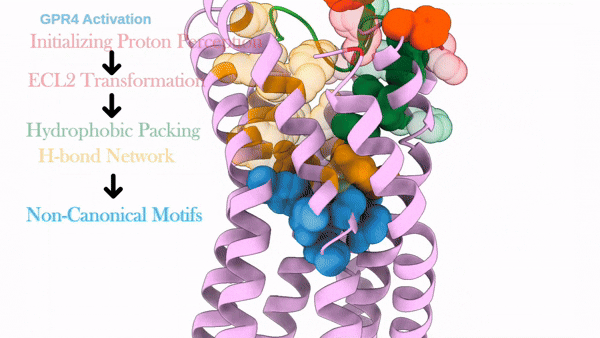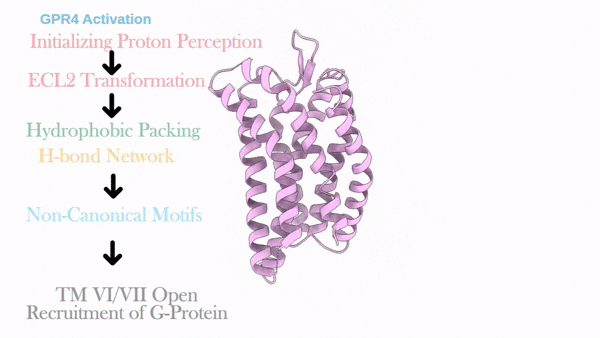
GPR4质子感应及激活的动态过程
同期,山东大学孙金鹏教授团队报道了质子受体响应质子激活的偏向性信号传导分子机制(Structural basis and biased signaling of proton sensation by GPCRs mediated by extracellular histidine rearrangement)。这两项互补性研究共同揭示了质子受体信号转导的全景图,为理解其激活密码提供了分子水平上的全面认知。
浙江大学基础医学院张岩教授,浙江大学医学院附属邵逸夫医院蔡秀军教授、毛春友研究员和南京医科大学药学院韩峰教授为该论文共同通讯作者。浙江大学博士生陈礼楠、良渚实验室博士后周辉、浙江大学医学院附属邵逸夫医院助理研究员席昆、浙江大学博士生程诗卓、刘勇锋和南京医科大学药学院讲师傅逸凡为本文共同第一作者。此外,东南大学博士生马翔宇,南华大学硕士生徐萍,浙江大学博士生戢素玉、沈丹丹,博士后王伟伟、张会冰等也做出了重要贡献。东南大学生命科学与技术学院柴人杰教授,浙江大学软件学院章敏教授,基础医学院杨林研究员和良渚实验室沈庆亚副研究员对本论文提供了重要支持。



