小肠是机体获取外部营养物质的首要吸收部位。营养进食在促发小肠吸收机制的同时,也在上皮屏障和免疫稳态调控中发挥关键作用。进食规律或营养成分的紊乱将导致小肠功能失衡进而诱发肠道炎症性疾病。王迪团队之前系统阐明小肠双向营养供应(肠内营养vs肠外营养)对于肠道营养吸收和免疫屏障的独特生理和病理意义,然而进食营养如何促发营养吸收机器的快速组装,进而实现营养吸收-免疫调节-屏障功能的协同适应,仍然是亟待阐明的重要科学问题。同时对于此过程中进食营养的关键感知和执行分子也知之甚少。
2025年7月24日,浙江大学基础医学院王迪团队在Immunity杂志上发表题为Gasdermin-D-mediated epithelial-immune circuit synchronizes nutrient absorption and host defense in the small intestine的研究论文。该工作揭示了小肠上皮细胞中的GSDMD响应进食营养信号,介导肠细胞表面关键营养吸收机器—刷状缘(brush border)的组装,并塑造肠细胞在小肠绒毛上的吸收与防御功能的空间区隔(functional zonation),并通过代谢-表观重编程实现免疫调节和屏障功能的协同适应。

研究人员首先发现GSDMD在肠道中的表达模式具有时空特异性,其在营养吸收高度活跃的近端小肠肠细胞中表达水平更高,同时与脂质吸收基因表现出相似的昼夜节律性。十二指肠中的GSDMD活化依赖于进食营养而非菌群信号。生信分析显示GSDMD与肠道脂质吸收、刷状缘组装以及免疫功能密切相关。随后,研究人员通过多种实验证明,GSDMD通过介导钙离子依赖的刷状缘组装促进小肠的脂质吸收。由于肠细胞本身具有功能上的空间异质性,比如绒毛顶部的肠细胞更多表现出营养吸收功能,而底部的肠细胞则有更强的防御功能。研究人员发现上皮细胞GSDMD缺失后,更多肠细胞具有底部的防御特征,而顶部吸收型的肠细胞减少。同时上皮内γδ T淋巴细胞(γδ T-IELs)的数量和功能也显著下降,并伴随上皮屏障的明显受损。机制上,GSDMD缺失改变了肠细胞内的代谢状态,并通过代谢-表观重编程,使上皮来源的关键因子如IL-15的表达下降进而破坏了γδ T-IELs的生存微环境,导致屏障功能受损和防御功能的减弱。最后,研究人员通过模拟紊乱的进食方式以及
均衡的营养组成,从不同角度揭示GSDMD介导的上皮-免疫环路对于肠道稳态具有重要意义。
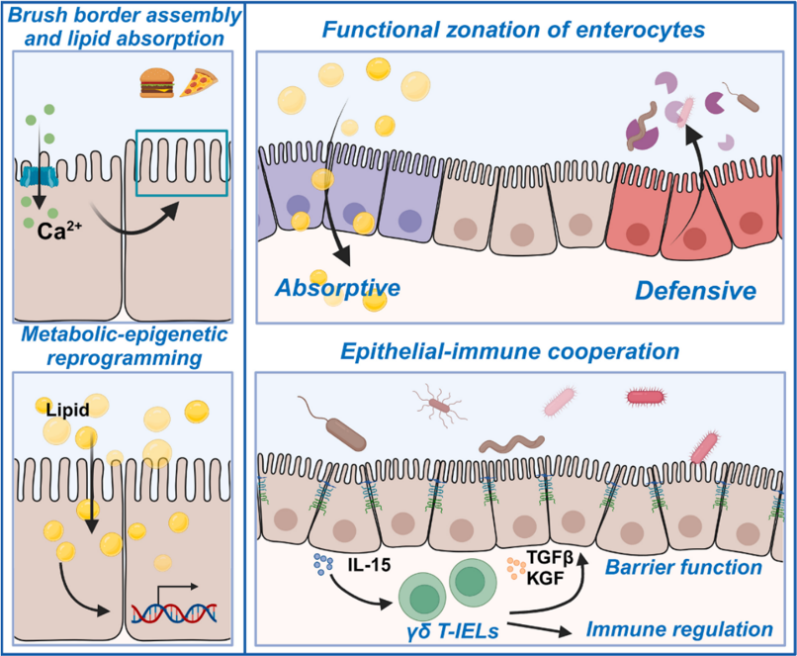
综上所述,本研究发现肠细胞GSDMD可以促进小肠脂质吸收,介导代谢-表观重编程和上皮-免疫环路塑造吸收和防御平衡。该工作揭示了进食营养调控免疫反应并维持肠道稳态的新机制,对精准饮食干预具有潜在指导意义。值得一提的是,这是王迪团队继Science Immunology(2022)、Developmental Cell(2022)和Nature(2024)三篇工作分别揭示了GSDMD在大肠粘液分泌、溶酶体调控、组织损伤修复中的生理功能后,在GSDMD非焦亡生理功能领域再次取得的新发现。
浙江大学基础医学院王迪教授、医学院池哲勖研究员为本文通讯作者,俞钱舟博士和蒋丹露博士为本文共同第一作者。



