抗生素耐药性(AMR)已成为全球公共卫生面临的重大威胁。随着细菌耐药机制不断演化,许多传统抗生素疗效大幅下降。替加环素作为第三代四环素类抗生素,是临床应对多重耐药革兰阴性菌感染的重要“最后防线”之一。近年来,替加环素耐药甚至“泛耐药”菌株的涌现,正逐步蚕食这道脆弱防线。
在众多耐药机制中,RND(resistance-nodulation-division)家族外排泵能够主动将多种抗生素泵出细菌细胞外,是导致多药耐药(MDR)的关键原因之一。近年来,一类位于可转移质粒上的新型RND外排泵——TMexCD1-TOprJ1的出现引起了广泛关注,它能赋予细菌对替加环素等药物强大的耐药能力。虽然其遗传和生化特性已有初步研究,但结构层面的探索仍属空白,这留下了诸多未解之谜:该复合物如何组装?如何精准地完成药物外排?小分子抑制剂又是如何对其“一剑封喉”?这些关键结构信息的缺失,已成为开发新型抗菌药物和高效外排泵抑制剂的主要瓶颈。
2025年11月14日,浙江大学基础医学院冯友军课题组与冯钰课题组、复旦大学甘建华课题组等通力合作,在Nature Communications发表题为Assembly and inhibition of transferable TMexCD1-TOprJ1 efflux pump的研究长文,首次通过冷冻电镜(cryo-EM)单颗粒技术解析了TMexCD1-TOprJ1外排泵的结构基础及其与抑制剂NMP的复合物结构,分辨率分别为2.97 Å和3.0 Å。这是该课题组继揭示细菌脂代谢与耐药机制后的又一重要进展(Nat Struct Mol Biol, 2025; Sci Adv, 2024)。

研究团队首先构建了TMexCD1-TOprJ1外排泵的复合物表达与功能验证体系,证明该外排泵可显著提升宿主对替加环素等多种抗生素的耐药水平。在此基础上,研究人员利用冷冻电镜单颗粒重构技术,成功解析了该外排泵的高分辨率整体结构(图1)。结构清晰地显示,内膜转运蛋白TMexD1、周质蛋白TMexC1和外膜通道蛋白TOprJ1以3:6:3的比例,精巧地搭建起一条从内膜贯穿至外膜的完整“门户”,从而实现将药物直接从细胞内部泵送至外部的功能。
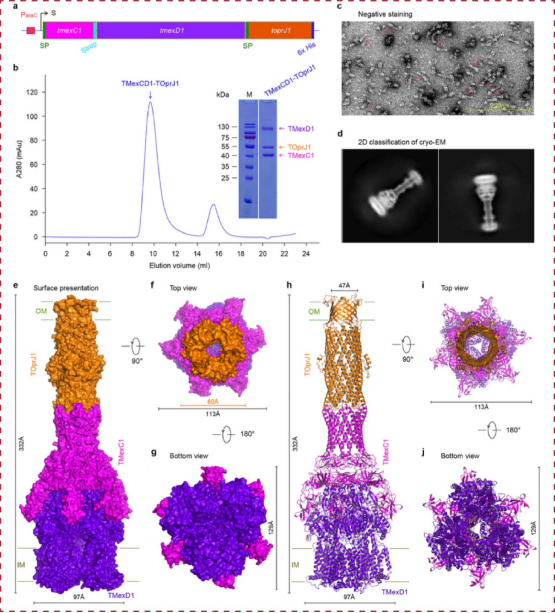
图1:TMexCD1-TOprJ1药物外排的结构基础
为了进一步阐明TMexCD1-TOprJ1的功能特性,研究团队通过遗传学和系统发育分析,揭示了该外排泵在不同菌株中的分布特点及其在可转移耐药质粒上的流行趋势,并通过MIC测定和药敏实验证实,TMexCD1-TOprJ1的获得可显著提高宿主菌对替加环素及相关抗生素的耐药性(图2)。
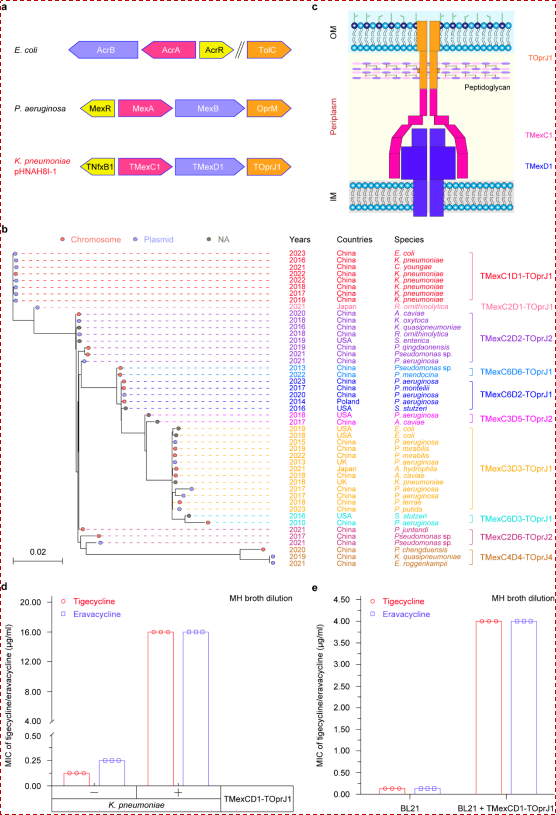
图2: TMexCD1-TOprJ1外排泵的遗传、系统发育及功能分析
细菌这一外排机制的启动促使我们思考:能否有效抑制这一外排过程?为此,我们聚焦于其抑制机制,并成功捕获了TMexCD1-TOprJ1与经典抑制剂NMP的复合物结构。结构分析表明,NMP分子精确嵌入TMexD1远端腔穴的一个关键结合口袋中,通过与一系列保守残基的稳定相互作用,将外排泵“锁死”在R态构象,从而有效阻断药物的外排(图3)。基于此,体内外药敏实验均证明,NMP能显著逆转携带该外排泵菌株的耐药性,为“外排泵抑制剂联合传统抗生素”的协同疗法提供了关键的理论与实验支撑。![]()
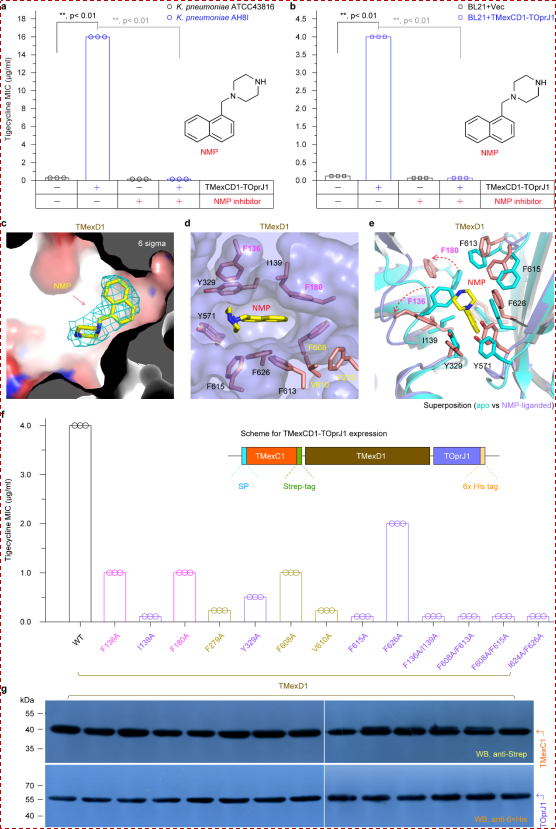
图3: 外排泵抑制剂NMP的分子机制
本研究不仅解析了多个关键功能状态的结构,更通过突变实验验证,首次系统描绘了TMexCD1-TOprJ1外排泵的组装模型(图4):始于TMexD1在内膜形成三聚体核心;继而TMexC1六聚体作为中坚支架与之对接,桥接周质空间;最终TOprJ1三聚体完成顶层装配,形成一条连续的跨膜外排通道。该模型从静态结构迈向动态组装过程,为深刻理解可转移RND外排泵在临床菌株中的高效定植与运作机制提供了关键物理模型,也为开发靶向该组装通路的新型抑制剂开辟了新路径。![]()
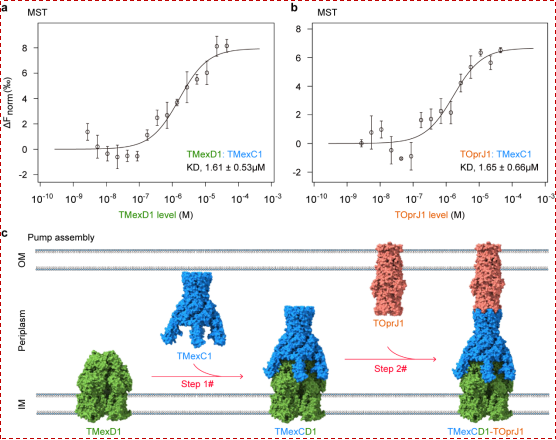
图4: TMexCD1-TOprJ1外排泵的装配模型
在临床应用前景方面,TMexCD1-TOprJ1等可转移RND外排泵的持续扩散,预示着替加环素等“最后防线”药物正面临严峻挑战。本研究通过解析TMexCD1-TOprJ1的一系列关键结构,结合功能实验证实该组装模型,并揭示外排泵抑制剂NMP的精细作用机理,为深入理解可转移替加环素耐药提供了理论基础。鉴于上述生化信息,未来有望理性设计出专一性更强、亲和力更高的新一代TMexCD-TOprJ靶向抑制剂,与现有抗生素联合使用,构建“抑制外排+作用靶点”的双重疗法,为逆转RND泵介导的耐药、应对超级耐药菌感染提供新的理论基础和潜在策略。
冯友军课题组长期聚焦“细菌脂代谢与耐药/致病性的机制”研究,发表重要研究论文100余篇,累计引用13000余次(h-index: 56)。该研究工作获得了国家自然科学基金委的杰青项目(32125003)、耐药重点专项(32141001)、重点项目(31830001)等基金的联合资助。浙江大学基础医学院冯友军课题组博士毕业生史钰、华南农业大学博士生李梦圆、西北工业大学副教授崔涛系该研究论文的共同第一作者;冯友军课题组博士后黄昊旻和广西大学博士生粟智为论文的完成做出了重要贡献;浙江大学基础医学院冯友军教授、冯钰副教授和复旦大学甘建华教授担任该研究论文的共同通讯作者。



