肌萎缩侧索硬化症(Amyotrophic lateral sclerosis,ALS)是最为常见且目前仍是无法治愈的运动神经元疾病。该病的主要病理特征表现为运动皮层、脑干以及脊髓前角的运动神经元渐进性死亡,由此引发受这些神经元支配的肌肉出现进行性萎缩,致使患者丧失肌肉控制能力,影响语言表达,最终死因多为呼吸运动失能。ALS的病程进展迅速,多数患者在症状出现后的3-5年内便会不幸离世。尽管谷氨酸介导的兴奋性神经元毒性和神经元氧化应激被广泛认定为ALS的主要发病机制,然而,临床上目前仅有的三种药物,直接靶向谷氨酸介导的兴奋性毒性的利鲁唑,针对神经元氧化应激的依达拉奉,和作用于SOD1 mRNA的托夫生,3种药物的疗效却差强人意。托夫生的潜在疗效仅局限于部分SOD1基因突变型ALS患者;而利鲁唑和依达拉奉虽然能短暂延长患者生存期,却未能显著改善其运动等神经功能。这提示单纯靶向神经元的治疗策略存在局限性。因此,本研究将焦点转向探索非神经元细胞,尤其是小胶质细胞在ALS疾病进程中的作用。
小胶质细胞作为中枢神经系统(CNS)的主要免疫细胞,承担着免疫监视、吞噬作用及炎症调节等重要功能,在维持CNS的稳态中发挥着重要作用。在ALS患者及动物模型中,CNS中小胶质细胞呈现出过度活化状态。离子稳态与膜电位的变化对小胶质细胞维持自身稳态起着关键作用。在阿尔茨海默病、帕金森病以及脑缺血等神经系统疾病中,靶向小胶质细胞离子通道的治疗策略已经展现出一定的治疗潜力。然而在ALS的研究中,鲜少针对小胶质细胞离子通道的探索。因此,亟需探索新的小胶质细胞离子通道靶点以开发更有效的ALS干预策略。
近日,浙江大学附属邵逸夫医院和基础医学院的赵经纬教授和病理科姜支农主任联合华大生命科学研究院韩磊博士团队在《Advanced Science》期刊上在线发表了一篇题为“Microglial HVCN1 deficiency improves movement and survival of SOD1G93A ALS mice by enhancing microglial migration and neuroprotection”的研究论文。该研究借助生物信息学数据挖掘表明,电压门控质子通道HVCN1作为小胶质细胞中表达最为丰富且特异性高的离子通道,在ALS患者以及小鼠模型的小胶质细胞中,其表达均显著上调。在ALS小鼠模型中,特异性敲除小胶质细胞中的HVCN1可提高运动神经元的存活率、减少神经肌肉接头的去神经支配比例、减轻胶质细胞的活化程度、并降低错误折叠蛋白和残存髓鞘碎片的水平。尤为关键的是,这些在病理层面的积极改善,切实有效地转化为ALS小鼠运动功能的显著提升以及生存期的有效延长。进一步研究显示,HVCN1缺失能够增强小胶质细胞的迁移能力,并促进其向稳态表型转化,同时提升其对神经元的营养保护功能。在机制层面,HVCN1敲除通过抑制Akt信号通路,进而增强小胶质细胞的迁移能力。该研究凸显了HVCN1作为ALS干预新靶点的治疗潜力。
离子通道是继GPCR之后的第二大药物研发靶点。在ALS领域,目前所有靶向离子通道的药物均针对神经元离子通道,而小胶质细胞离子通道的潜在作用长期被忽视。该研究利用公共数据库筛选出质子通道HVCN1在小胶质细胞特异性高表达,并明确HVCN1在ALS小胶质细胞表达上调。进一步,在ALS小鼠小胶质细胞特异性敲除HVCN1,结果表明HVCN1缺失能显著改善小鼠病理、提升运动功能并延长生存期。机制上,HVCN1缺失可增强小胶质细胞的神经保护功能,并通过Akt信号通路增强小胶质细胞的迁移和稳态/抗炎表型。该研究确立了小胶质细胞特异性表达的HVCN1作为ALS治疗新靶点的潜力,为后续开发靶向HVCN1的药物、探索小胶质细胞表面其他受体及其在ALS等神经疾病中的功能提供了新方向。
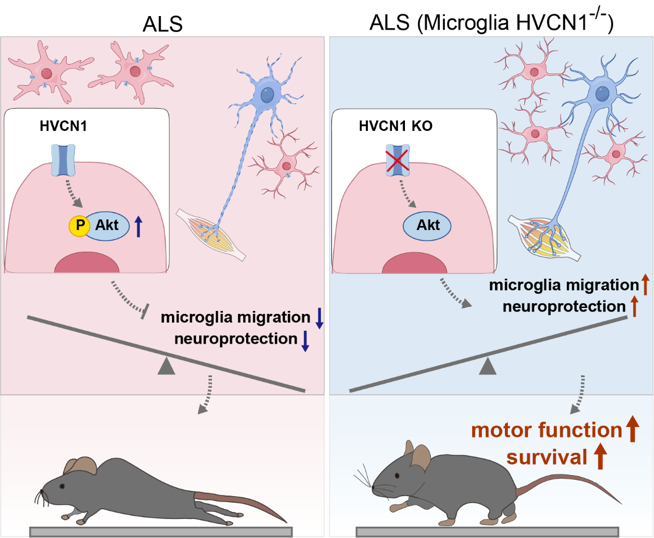
敲除小胶质细胞质子通道改善肌萎缩侧索硬化症小鼠运动并延长存活期
该研究的第一作者为浙江大学附属邵逸夫医院和基础医学院的博士后汪帆,浙江大学基础医学院和附属邵逸夫医院赵经纬教授、浙江大学医学院附属邵逸夫医院病理科姜支农主任、华大生命科学研究院韩磊研究员为共同通讯作者。本研究得到了科技部脑科学与类脑研究国家科技重大专项(脑计划)项目、国家自然科学基金等项目的支持。



