近日,浙江大学药学院“百人计划”研究员赵宇团队联合南开大学化学学院刘阳教授在Angew. Chem. Int. Ed.期刊发表题为“Visible Light-Driven Membrane-Bound Compartment for Precise Regulation of Enzyme Activity”的研究论文。论文中指出,研究团队开发了一种可见光驱动的人工脂质膜隔室系统,该系统膜的通透性可通过程序化光照模式实现动态控制,进而实现对封装酶活性的精准调控。

酶活性精确调控的技术挑战
目前,光响应策略主要分为两类:一类基于光敏抑制剂,其通过自身异构化调节与酶活性位点的结合,但每种酶都需从头设计抑制剂,通用性差;另一类依赖于光异构分子共价交联活性中心附近的残基,或利用光响应聚合物遮蔽活性位点,进而调控与底物的识别。然而,这些方法通常需要对酶进行残基突变或化学修饰,过程复杂且可能影响酶的天然功能。因此,当前仍需一种无需定制化抑制剂或酶工程、即可实现高效光学调控催化过程的通用策略。
隔室化的仿生策略
隔室化是生物体内实现代谢途径调控的一种基本策略。从细菌的微隔室到真核生物的细胞器,膜包被的隔室通过其膜上的门控通道蛋白来调控代谢物的选择性运输。这些通道蛋白通过构象变化来允许或限制特定底物的穿过,从而精确调节隔室内部的生化反应。受此启发,研究团队报道了一种由苯偶氮噻唑门控脂质和磷脂组成的人工膜隔室。在该系统中,苯偶氮噻唑脂质在可见光照射下可发生可逆的光异构化反应,表现为分子持续的翻转-旋转运动。这一过程可显著增强隔室膜的渗透性,促进底物分子的跨膜传输;当光照移除后,脂质膜又恢复至低渗透性状态,从而实现膜通透性的动态控制。通过将生物酶封装于该隔室内部,可实现对酶活性的精准、分级调控。该方法无需对酶分子进行化学修饰或残基突变,从而完全保留了酶的天然结构与生物活性。除“全开/全关”式二元调控之外,该系统还可借助光照模式的精确设计,实现酶活性的连续梯度调节,显著提升了功能调控的精细度和适用性。
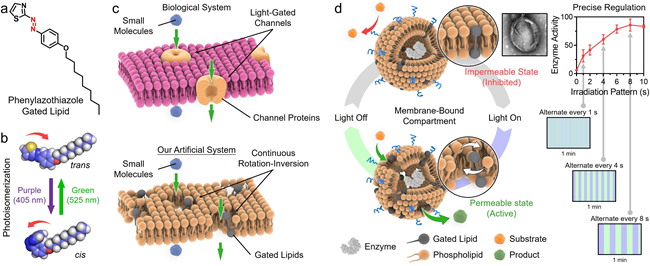
图1. 可见光驱动的脂质人工膜隔室精准调控酶活性。a,苯偶氮噻唑门控脂质。b,光异构化。c,天然的门控隔室化策略与仿生人工膜隔室策略。d,酶活性的精准分级调控。
可逆调节过氧化氢酶和葡萄糖氧化酶的活性
该门控隔室化策略成功实现了对过氧化氢酶(CAT)与葡萄糖氧化酶(GOx)活性的可逆、重复调控,能够多次切换酶促反应的“开启”与“关闭”状态。研究团队进一步评估了该策略在构建可控饥饿疗法用于癌症治疗方面的应用潜力。
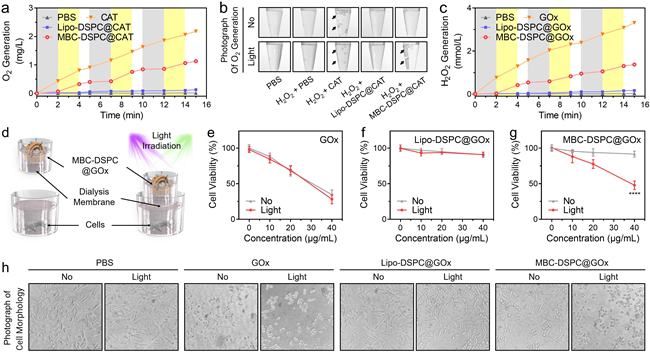
图2. 可逆调节过氧化氢酶和葡萄糖氧化酶的活性。a,b,通过测定氧气产生评估过氧化氢酶的活性调控。c,通过测定双氧水产生评估过葡萄糖氧化酶的活性调控。d,体外评估癌症可控饥饿疗法的装置。e,f,g,h,可控饥饿疗法体外效果。
酶活性的分级精准调控
传统的光响应抑制剂或抑制剂-酶偶联策略依赖于在酶活性位点处的竞争性结合,通常以“完全激活”或“完全抑制”的二元模式运作。相比之下,本研究提出的隔室系统可通过编程光照时间与模式,实现对酶活性的梯度式调控。该系统通过可调地控制底物进入及反应动力学过程,为光控酶促反应提供了一种机制迥异且更精细的调控策略。
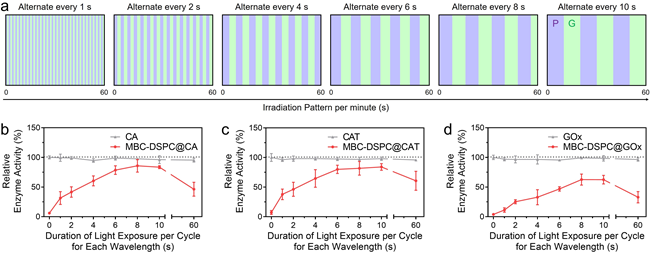
图3. 通过精确调控光照模式可实现酶活性的分级精准调控。a,一分钟内时序光照模式的示意图,标注了每次光照事件的持续时间、频率与间隔。b,碳酸酐酶(CA)活性的精准调控。c,CAT活性的精准调控。d,GOx活性的精准调控。



