2025年12月30日,浙江大学动物科学学院石恒波课题组联合北京生命科学研究所王伟课题组、浙江大学爱丁堡大学联合学院王超尘课题组在《Cell Discovery》在线发表题为“Luminal hormone-responsive cells tune the regenerative remodeling of mammary glands in large mammals”的研究论文。该研究以奶山羊为模型,发现乳腺腔内激素敏感细胞(luminal hormone-responsive cells,LumHR)是调节乳腺再生性重构的“开关”。LumHR 通过催乳素受体(prolactin receptor, PRLR)信号调控分泌型前体细胞(luminal secretory progenitor,LumSecP)向分泌型细胞(luminal secretory cell,LumSec)分化,从而协调乳腺再生性重构进程。该发现不仅加深了对大型哺乳动物乳腺重构机制的理解,也为开发乳腺发育调控策略以提高泌乳性能提供了新靶点。

组织重构是发育与再生过程中普遍存在的核心生物学过程,其失衡常导致发育异常、功能受损,并增加疾病风险。在哺乳动物妊娠与泌乳周期中,乳腺经历腺泡扩张、退化等一系列动态重构过程,该过程对乳腺健康与泌乳性能尤为重要,特别是在牛羊等泌乳动物中具有显著意义。
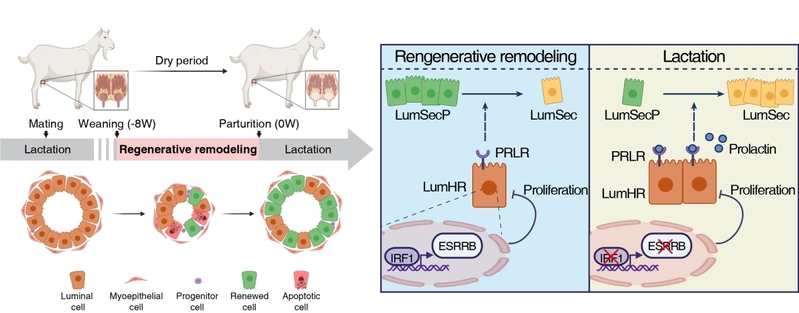
常规情况下,哺乳结束后乳腺上皮细胞大量凋亡,腺泡完全萎缩,乳腺组织会退化至类似妊娠前的状态,这种模式被称为典型退化模式(typical involution)。然而,在奶业生产中,为提升产奶效率,奶牛和奶羊农业动物通常在妊娠后期实施断奶,使乳腺退化与妊娠过程重叠。在此过程中,乳腺保留腺泡结构以快速更新上皮细胞,使得产后乳腺迅速恢复分泌能力,这一特殊模式被称为乳腺再生性重构(regenerative remodeling,RR)。研究显示,缩短乳腺再生性重构时间显著降低下一周期总产奶量(超过20%),凸显该过程对乳腺组织更新和泌乳潜能的重要性。尽管已有研究观察到再生性重构期间乳腺组织的显著形态变化,但其背后的细胞谱系动态与分子调节机制仍知之甚少。
乳腺再生性重构在人类、啮齿类和反刍动物等多种物种中均存在。相比其他动物,奶山羊(Capra hircus)体型适中、可操作性高、组织结构与人类更接近等,是研究乳腺重构的理想大型动物模型。研究团队在萨能奶山羊上,利用单细胞测序、表观遗传与组织学分析等方法,系统描绘了再生性重构期间乳腺细胞谱系及基因调控网络的变化特征。研究发现,在再生性重构过程中,LumSecP显著积累,而表达激素受体的 LumHR 细胞比例显著下降,对于 LumSecP 的积累至关重要。通过乳腺类器官以及在小鼠靶向消融 LumHR试验,证实 LumHR 是调控 LumSecP 积累与分化的核心调节开关。进一步地,通过整合单细胞转录组与ATAC-seq等多组学数据,研究团队鉴定出转录因子 IRF1 是限制 LumHR 扩增的关键负调控因子。乳腺再生性重构期,IRF1表达升高,通过上调 ESRRB 阻止 LumHR 的过度扩增;而在 IRF1 活性降低或缺失的情况下,LumHR 异常扩增,驱动 LumSecP 向 LumSec 分化,加速再生性重构过程。综上,该研究揭示了乳腺再生性重构中“细胞谱系关键因子”之间的协同调节机制,强调靶向谱系与特异性分子可为调控乳腺发育与组织更新提供有效策略。
奶业科学研究所石恒波副研究员、北京生命科学研究所王伟研究员和浙江大学王超尘研究员为本论文共同通讯作者。石恒波实验室的博士研究生厉甬涛、罗涛,王伟课题组博士研究生张丽萍为共同第一作者。浙江大学刘建新教授、彭金荣教授、林盛达研究员及西北农林科技大学罗军教授为本研究提供了重要支持。本研究得到国家生物育种重大专项与国家自然科学基金的资助。



