细胞核内存在诸多由各类核蛋白凝聚形成的无膜细胞器,在基因转录和RNA剪切等各个方面发挥着重要作用。众所周知,蛋白质的翻译合成发生在细胞质内。那为什么这些核蛋白在细胞质内合成出来以后,不会发生异常相分离呢?此外,大部分核内无膜细胞器的直径均大于核孔。那这些核蛋白需要被转运出核的时候,是何种机制来调控其凝聚,以确保其可以顺利通过核孔复合物呢?
课题组长期研究由NPAT蛋白凝聚所形成的核内无膜细胞器-组蛋白基体(Histone Locus Body)。这一结构是细胞核内组蛋白基因转录的物理场所,决定了细胞的增殖。因此,课题组以组蛋白基体和NPAT为模型,对上述科学问题进行探索,并于2025年在《Journal of Cell Biology》杂志发文,揭示了核运输受体蛋白KPNA3在转运NPAT入核的同时,能够通过空间位阻效应来抑制NPAT的凝聚,从而保证组蛋白基体不会在细胞质中发生错误组装。这一工作提出“空间位阻模型”(Steric hindrance model)是KPNA3调控NPAT凝聚及组蛋白基体组装的关键策略。
在此基础上,课题组进一步提出科学问题:在NPAT转运出核的时候,调控其相分离的关键分子及机理是什么?并于2026年1月2日于《Journal of Cell Biology》杂志再次发文,揭示了出核转运受体蛋白CRM1对核蛋白转运及凝聚的“一石二鸟”调控功能。研究人员通过免疫共沉淀及组学筛选,发现出核转运受体CRM1(exportin1)能够特异性地结合NAPT,并驱动NPAT的转运出核。课题组进一步确认了NPAT的凝聚受到CRM1的抑制,并鉴定了NPAT序列中受CRM1调控凝聚的关键序列。一系列生化实验揭示:在介导NPAT发生凝聚的关键序列中,隐藏着一段与CRM1结合的出核信号序列。因此,CRM1在介导NPAT出核的同时,还竞争性地破坏了其自我互作,并抑制其发生凝聚。我们将这一调控策略命名为“竞争性占据模型”。值得一提的是,CRM1的疾病相关突变则丧失了对NPAT凝聚的调控作用。本研究通过解析核蛋白NPAT在出核转运中调控凝聚的机制,阐明了核内无膜细胞器组蛋白基体的动态调控机理。
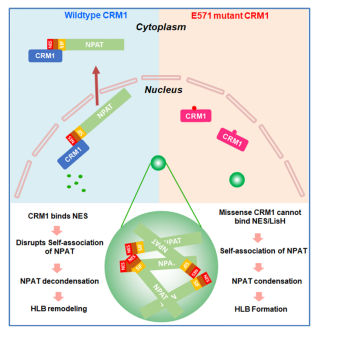
本研究提出的“竞争性占据机理”的模式图
综上,课题组的两篇论文,以组蛋白基体和NPAT分子为研究模型,分别解析了核内蛋白在出核与入核过程中,其凝聚状态分别受到“竞争性占据模型”和“空间位阻模型”的不同调控方式,为核蛋白的凝聚调控提出了理论解释。主要工作由从晓霞博士和徐水波博士完成,邹文凯博士研究生及浙四医院研究员高修奎为共同第一作者,郑莉灵副教授、周以侹教授和邹晓晖研究员为共同通讯作者。本研究受到基金委创新研究群体和面上项目等资助。课题组常年招收博士后研究员,近期在招募研究助理,有意者请联系郑莉灵老师:zhengliling@zju.edu.cn。



