近日,浙江大学脑科学与脑医学学院、脑与脑机融合前沿科学中心、浙江大学医学院附属第二医院和良渚实验室孙丽/段树民团队在《Cell Reports》上在线发表题为“Transthyretin-mediated regulation of neuropathic pain and anxiety-like behavior in the lateral parabrachial nucleus”的研究论文,揭示了外侧臂旁核中转甲状腺素蛋白通过RAGE/NF-κB信号轴调控神经病理性疼痛与焦虑共病的关键分子机制。

神经病理性疼痛是一种由躯体感觉神经系统损伤或疾病引起的慢性疼痛,全球患病率高达7%–10%,严重影响患者生活质量。临床上,此类疼痛常与焦虑、抑郁等情绪障碍高度共病,形成“疼痛–情绪”恶性循环,不仅加剧患者痛苦,也大幅增加了治疗难度,但疼痛与焦虑共存的深层细胞与分子机制尚不明确。
研究团队基于之前的研究,系统揭示了外侧臂旁核(LPBN)在神经病理性疼痛及焦虑共病中的作用机制。首先,通过建立腓总神经结扎模型(CPN)模拟临床常见的神经痛状态,进而利用单细胞RNA测序技术精细解析LPBN在神经损伤后的细胞类型特异性转录组变化。分析发现,LPBN谷氨酸能神经元中转甲状腺素蛋白基因(Ttr)表达显著上调,提示TTR可能参与疼痛调控。进一步的蛋白水平验证不仅证实了Ttr表达量的增加,更关键地发现了Ttr发生病理性聚集并形成了寡聚体,此异常聚集形式是Ttr发挥神经毒性作用的常见机制。
为明确Ttr的功能,研究团队运用了遗传学操作进行双向验证。一方面,在LPBN谷氨酸能神经元中特异性敲除Ttr基因,结果发现,这不仅能有效缓解神经损伤引起的机械性痛觉超敏和热痛觉过敏,还显著改善了小鼠在旷场实验和高架十字迷宫实验中表现出的焦虑样行为。电生理记录进一步显示,Ttr的敲除逆转了神经损伤导致的LPBN神经元过度兴奋。另一方面,在未受神经损伤的正常小鼠LPBN中特异性过表达Ttr基因,则足以单方面诱发与神经病理性疼痛类似的疼痛超敏和焦虑样行为。双向调控实验结果证明:LPBN谷氨酸能神经元中的Ttr,是驱动神经病理性疼痛与焦虑共病的充分且必要条件。
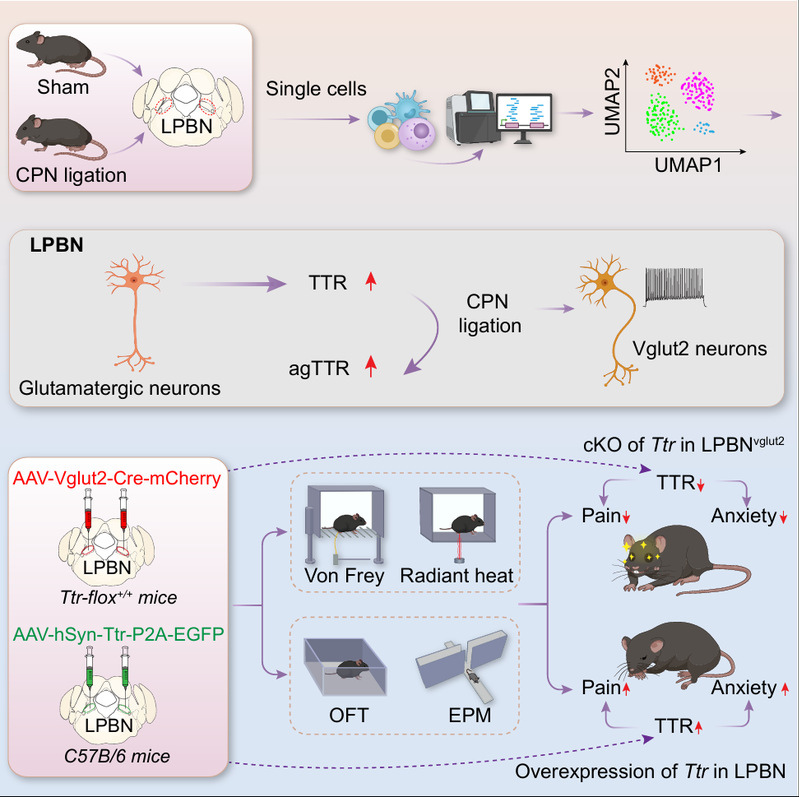
图1. 外侧臂旁核中TTR驱动神经病理性疼痛与焦虑共病的模式图
本研究深入揭示了TTR发挥功能的分子通路:聚集形式的TTR作为配体,与细胞膜上的晚期糖基化终末产物受体(RAGE)结合,进而激活细胞内的NF-κB炎症信号通路。该通路的活化最终导致了神经元的超兴奋性。LPBN局部给予RAGE特异性拮抗剂FPS-ZM1,成功逆转由TTR过表达或神经损伤所引发的疼痛与焦虑行为,并同步抑制了NF-κB通路的激活和神经元电活动的异常增强(图1)。
浙江大学医学院邓国闯博士为本研究的第一作者,刘丽博士及博士研究生刘博洋为共同第一作者,浙江大学脑科学与脑医学学院、医学院附属第二医院孙丽副教授为通讯作者。该研究工作得到了浙江大学医学院段树民院士的重要支持和指导,以及李相尧教授、徐贞仲教授和杨鸿斌研究员等的帮助。本研究在国家自然科学基金、科技创新2030重大项目、浙江省重点研发计划等项目的资助下完成。



