近日,浙江大学医学院脑科学与脑医学学院沈逸/周煜东课题组在《Brain》期刊上发表题为“Astrocytic mGluR5-dependent calcium hyperactivity promotes Aβ pathology and cognitive impairment”的研究论文。该研究揭示了星形胶质细胞代谢性谷氨酸受体5(mGluR5)参与阿尔茨海默病(AD)早期发病的分子机制。研究发现,海马CA1区星形胶质细胞mGluR5的高表达始于AD早期,是对症状前AD阶段Aβ寡聚体(Aβo)积聚增加的重要响应,也是驱动早期AD病程进展的关键因素。
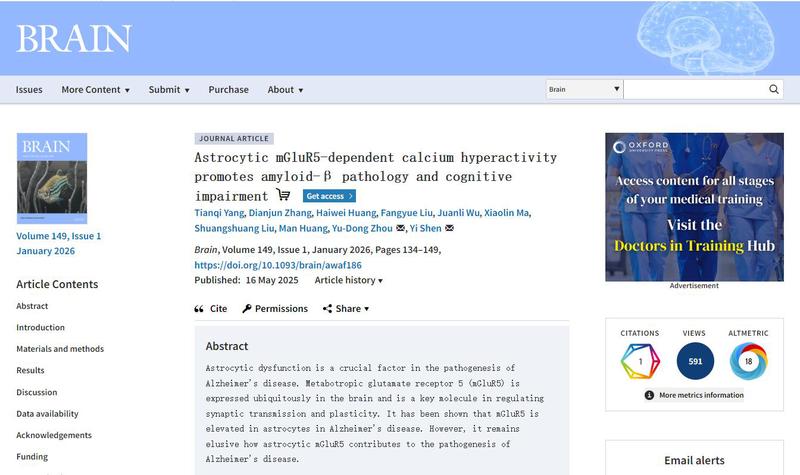
AD,即老年痴呆症,是一种常见的神经退行性疾病,其临床表现主要为记忆力减退、情感与行为异常、逐渐丧失独立生活能力等。目前我国的AD及其他痴呆患病人数超过1600万,占据全球AD及其他痴呆患病总人数的四分之一。AD的主要组织病理特征包括:由Aβ聚集沉积形成的胞外老年斑,以及由过度磷酸化tau蛋白形成的胞内神经纤维缠结。其中,Aβo引起的突触功能损伤是目前AD早期病理机制研究的热点之一。mGluR5在大脑中普遍表达,是调节突触传递和突触可塑性的关键分子。多项研究显示,Aβo能够通过mGluR5导致AD病理进程中突触传递的下降,这使mGluR5成为AD的潜在治疗靶点。本团队前期研究发现,免疫信号PIP2参与AD早期低浓度Aβo引起的突触前功能紊乱,其中突触前mGluR5-PLC-PIP2信号通路是主要作用靶点。除了神经元外,皮层和海马星形胶质细胞中也存在功能性mGluR5的表达。然而,目前星形胶质细胞mGluR5如何参与AD的发病机制尚不清楚。在本研究中,研究人员通过对死亡后人脑样本的分析发现,海马CA1区星形胶质细胞mGluR5的高表达始于AD早期,且其表达水平以Aβ病理依赖的方式与AD病程进展呈正相关。
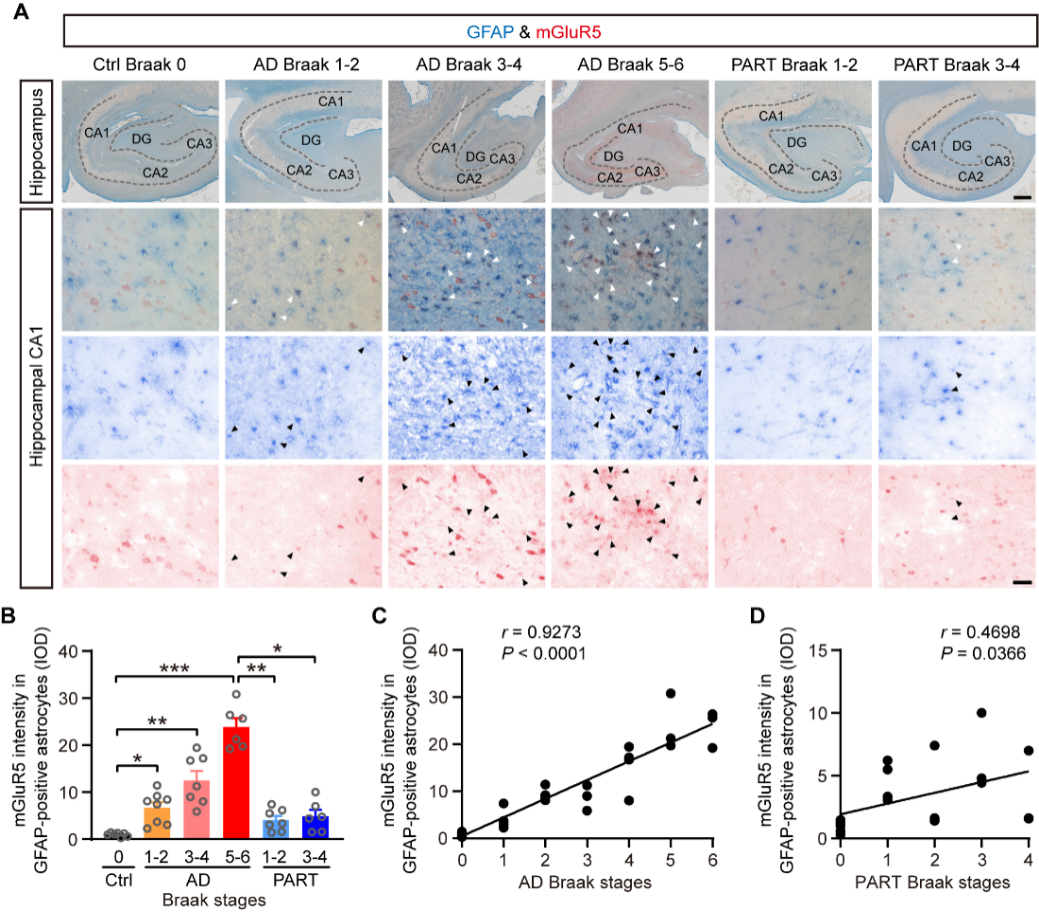
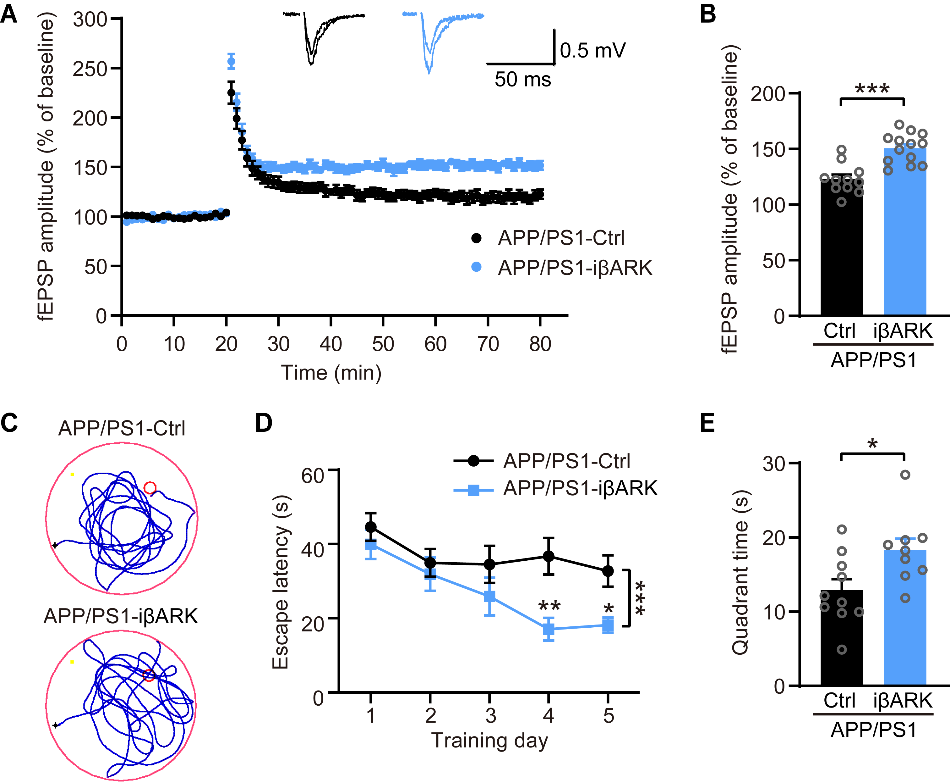
与此同时,研究还发现,在AD小鼠模型中,海马CA1区星形胶质细胞mGluR5表达的上调与致病性Aβ所诱导的突触缺陷呈现正相关。在AD早期,该区域星形胶质细胞mGluR5表达的增加,对促进AD小鼠突触功能损伤、Aβ沉积以及认知功能障碍既具有充分性,也具有必要性。进一步机制研究表明,星形胶质细胞mGluR5激活会引起细胞内钙信号过度增强,进而导致其对Aβ的摄取与降解功能失调,这是加速Aβ相关病理进展的关键基础。实验证实,在AD早期抑制星形胶质细胞内异常增强的钙信号,能够改善AD小鼠的突触缺陷与认知功能障碍,并减少Aβ沉积。
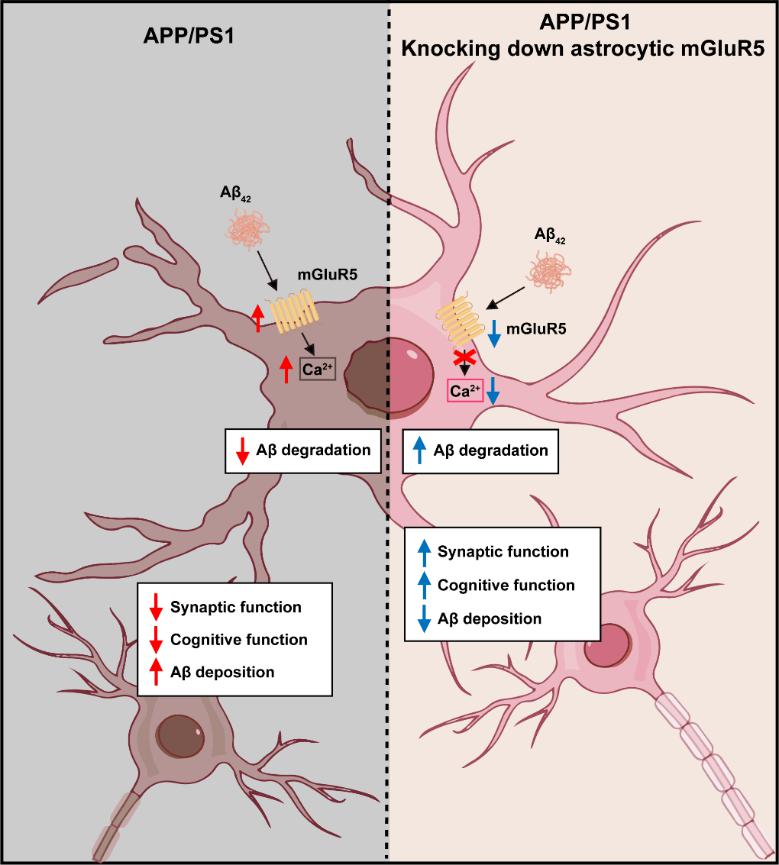
简言之,该研究揭示了星形胶质细胞mGluR5在可溶性Aβo诱导的AD早期发病机制中发挥重要作用,并指出其介导的钙信号过度增强是该过程的关键基础。该发现为在症状前AD阶段干预病程、延缓或改善后续不可逆性认知障碍提供了潜在新策略。在AD病变进入晚期不可逆阶段前,及早识别并干预其早期功能性异常,对于该疾病的诊断与治疗具有重要意义。
本文共同第一作者为浙江大学脑科学与脑医学学院杨天琦博士与博士生张殿君,沈逸教授与周煜东教授为共同通讯作者。本课题获得了科技创新2030重大项目、浙江省“尖兵领雁”科技计划项目及国家自然科学基金的支持。



