病毒感染的发生与发展取决于病毒感染特性及宿主免疫应答水平。近年来研究逐渐揭示,肠道菌群及其代谢产物在病毒感染过程中起着关键调控作用。其中,胆汁酸作为一类重要的信号分子,虽由肝细胞以胆固醇为底物进行合成,但其生物转化受到肠道菌群的精细调控,能直接或间接影响病毒生命周期与宿主免疫应答。
2026年1月27日,浙江大学动物科学学院朱书研究员课题组在Cell Press旗下知名微生物学期刊《Trends in Microbiology》发表题为“Role of bile acid metabolites in regulating viral infections”的综述论文,系统阐述了肠菌来源的胆汁酸如何通过直接作用于病毒及间接调控宿主免疫两条途径,深刻影响病毒感染进程。该文不仅梳理了胆汁酸在新冠病毒(SARS-CoV-2)、猪丁型冠状病毒(PDCoV)、诺如病毒(Norovirus)、基孔肯雅病毒(CHIKV)及发热伴血小板减少综合征病毒(SFTSV)等多种病毒感染模型中的调控功能,更为基于“微生物-胆汁酸”轴的抗病毒策略开发提供了新的视角和方向。
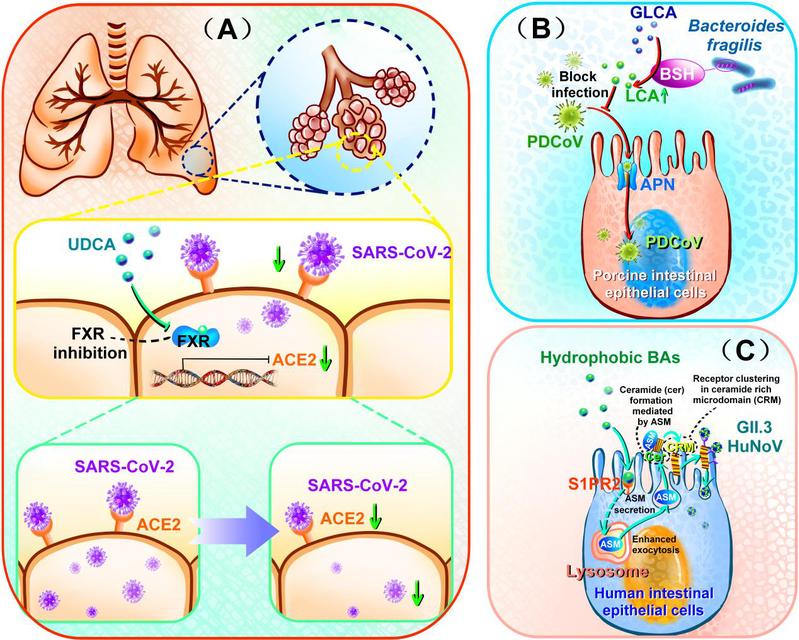
该文指出,胆汁酸对病毒感染最直接的干预体现在病毒进入细胞的环节,且表现出功能上的双重性(图1)。一方面,部分胆汁酸能够直接抑制病毒入侵。例如,在PDCoV感染中,肠道菌群紊乱导致具有胆汁盐水解酶活性(BSH)的脆弱拟杆菌(B. fraglis)耗竭,进而使次级胆汁酸如石胆酸(LCA)水平下降。补充LCA可直接阻断病毒刺突蛋白与细胞受体氨基肽酶N的结合,从而有效抑制病毒入侵。这一过程不依赖于免疫系统的激活,是胆汁酸直接发挥抗病毒作用的清晰例证。
另一方面,某些肠道病毒,如人类Norovirus GII.3则可利用胆汁酸促进自身感染。疏水性胆汁酸作为必需辅助因子,通过与宿主细胞膜受体S1PR2结合,为病毒侵入创造有利条件。这揭示了肠道菌群通过塑造胆汁酸谱,直接影响病毒入侵的分子基础。
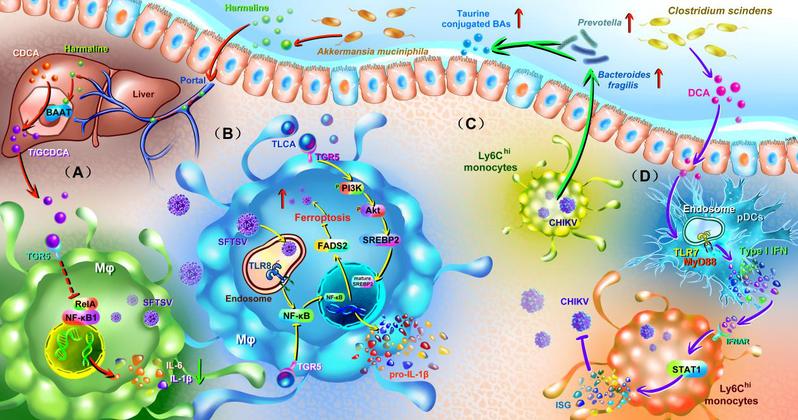
除了直接作用,胆汁酸还能作为重要的免疫调节分子,通过激活FXR、TGR5等胆汁酸受体,精细调控宿主抗病毒免疫与炎症反应,从而影响感染的整体严重程度及临床结局(图2)。在CHIKV感染中,由梭状芽孢杆菌(C. scindens)产生的次级胆汁酸脱氧胆酸(DCA)能够修复浆细胞样树突状细胞(pDC)中受损的TLR7-MyD88信号通路,从而增强I型干扰素应答,抑制病毒血症。在SFTSV感染中,嗜黏蛋白阿克曼菌(A. muciniphila)则可通过其代谢产物Harmaline促进结合型初级胆汁酸甘氨鹅去氧胆酸(GCDCA)及牛磺鹅去氧胆酸(TCDCA)合成,进而激活TGR5以抑制NF-κB驱动的全身性炎症,改善预后。值得注意的是,牛磺石胆酸(TLCA)对该病毒展现了双重功能:既能直接抑制病毒复制,又能通过TGR5-PI3K/AKT-SREBP2通路上调脂肪酸去饱和酶2(FADS2),抑制病毒诱导的铁死亡。这些发现共同阐明了胆汁酸在协调宿主全身抗病毒免疫与炎症平衡中的枢纽作用。
该综述进一步提出,目前研究虽已确立肠道菌群通过胆汁酸调控病毒感染的基本框架,但其机制具有高度情境依赖性。为推进该领域发展并开拓转化潜力,以下几个方向亟待深入探索:首先,需系统阐明在病毒感染过程中,肠道菌群如何动态调控关键胆汁酸代谢酶的活性,以及由此产生的胆汁酸谱变化如何精确影响免疫细胞功能与病毒复制周期。其次,除经典胆汁酸外,稀有或结构修饰的非典型胆汁酸在病毒感染中的作用尚属空白,可能蕴含新的调控机制。此外,理解这些相互作用的时空动态至关重要,未来需结合空间组学与纵向追踪技术,以解析其发生的具体情境。最后,靶向胆汁酸代谢通路或其受体(如FXR、TGR5)的药物干预,以及通过益生菌/元调控肠道菌群,均为开发新型“微生物组启发”的抗病毒策略提供了值得期待的前景。
浙江大学动物科学学院博士生张雅楠为论文第一作者,朱书研究员为通讯作者。该工作得到了国家自然科学基金等项目的资助。



