二甲双胍是临床治疗II型糖尿病的一线药物,近年来有日益累积的证据表明,其激活AMPK通路并抑制肝脏糖异生的直接作用靶点之一包括线粒体呼吸链复合物I。双胍类化合物降低血糖的药物效价随疏水性增强而提升,波动幅度超过103。苯乙双胍、丁双胍等疏水性双胍对有氧呼吸的抑制过强,临床实践中容易导致血液乳酸积累和酸中毒,已被多数国家停止使用。与之相比,高度亲水的二甲双胍得益于对复合物I的弱抑制而成为唯一安全有效的双胍类降糖药物。因此,阐明二甲双胍抑制复合物I的作用机制对II型糖尿病的治疗具有重要意义。

2025年11月10日,浙江大学基础医学院周龙课题组、生命科学学院周如鸿课题组、基础医学院张汕课题组、加州大学戴维斯分校分子与细胞生物学系James A. Letts课题组和浙江大学医学院附属邵逸夫医院重症科周建仓课题组合作在Nature Structural & Molecular Biology发表了题为Hydrophilic metformin and hydrophobic biguanides inhibit mitochondrial complex I by distinct mechanisms(亲水性二甲双胍与其他疏水性双胍药物通过不同的机理抑制线粒体复合物I)的研究论文。该工作通过结构生物学手段,结合分子动力学模拟和酶促反应动力学建模,提出了二甲双胍和强疏水的氯胍抑制复合物I的不同作用模型。二甲双胍仅在复合物I处于开放构象时才能进入,随后会被底物泛醌的结合和随之而来的复合物I 的闭合变构限制在醌通道最底部,从而阻断泛醌从氧化还原位点获得电子。
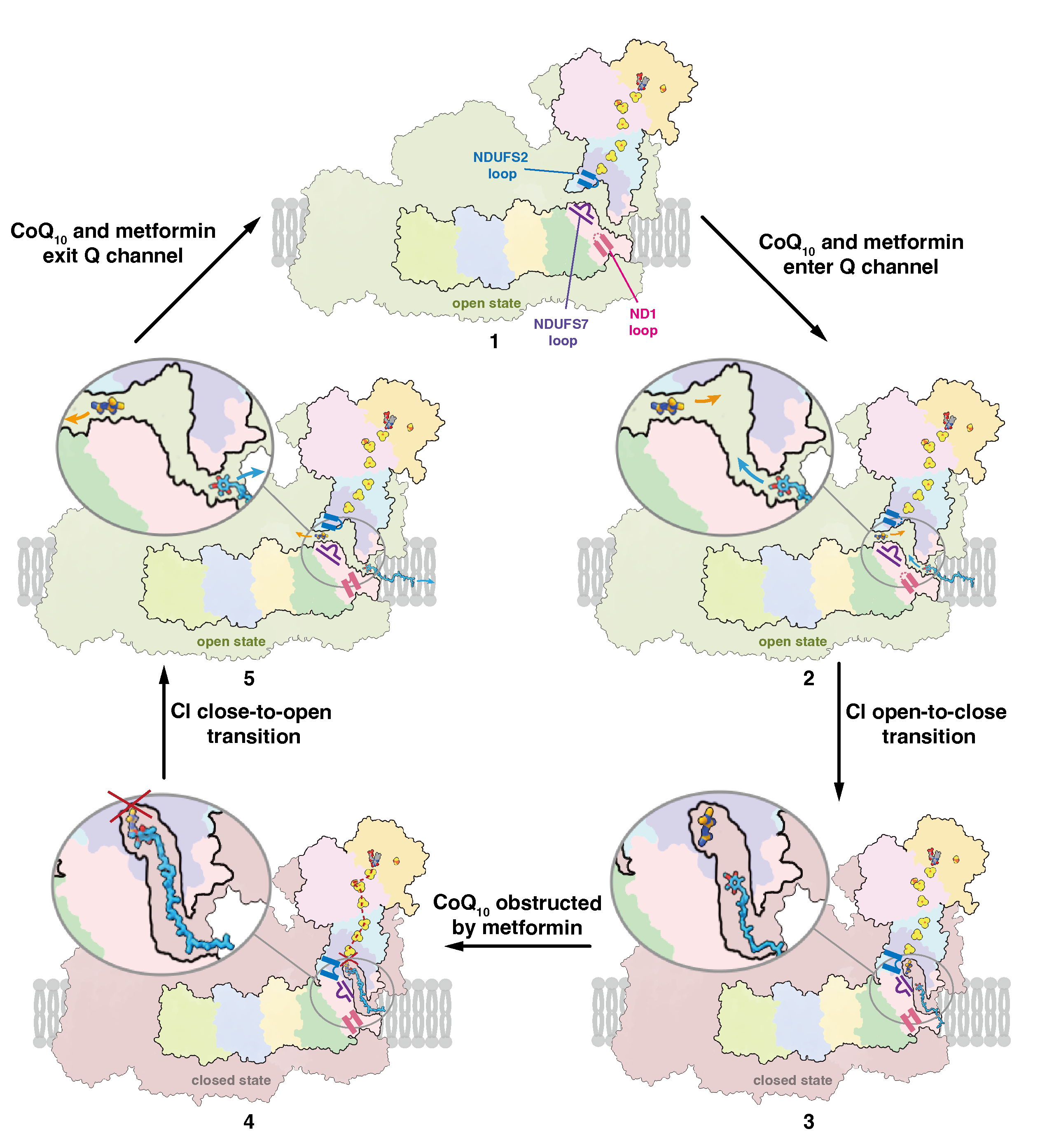
在本研究中,作者通过系统性的3D分类手段获取了一系列闭合构象的哺乳类复合物I的冷冻电镜结构,在其醌通道内同时结合有二甲双胍和泛醌分子。其中二甲双胍的电子密度与早先发表的晶体学密度类似,泛醌头部的电子密度与近期发表的结合在脂质体重构复合物I内的泛醌相近似。而开放构象复合物I的醌通道内未发现配体密度,未加药对照组的醌通道内仅存在条状的泛醌密度,未发现成形的二甲双胍密度。与之形成对比的是,强疏水的抗疟药物氯胍能结合开放和闭合构象的复合物I,而且能同时占据醌通道的入口处和底部的氧化还原位点。因此,与氯胍竞争性阻断泛醌进入复合物I的作用机理不同,二甲双胍与泛醌不存在竞争性关系,但是能阻止其到达醌通道底部的氧化还原位点。值得注意的是,分子动力学模拟验证了以上两种双胍的结合位点均是各自在醌通道中移动时结合能最低的位置。
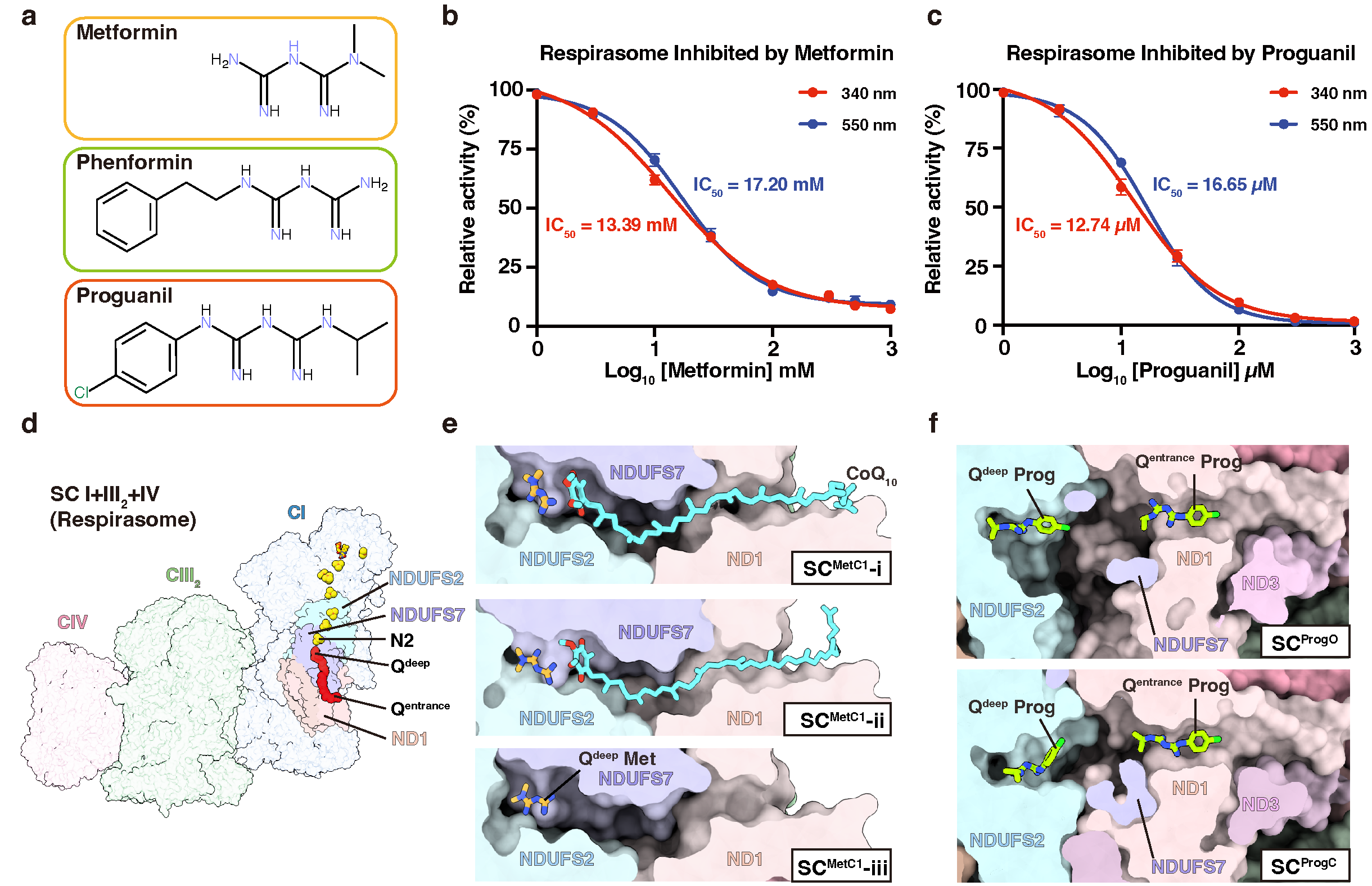
为了从酶促反应动力学层面验证上述作用机理,作者对二甲双胍和氯胍抑制复合物I的酶促反应过程进行了数学建模,提出了“有序结合-抑制剂捕获”和“构象依赖-竞争性抑制”两种动力学框架。通过区分两种双胍对开放与闭合构象复合物I的不同亲和力,并设置底物/双胍分子顺序结合过程中的各个平衡常数,推导出它们各自的表观最大反应速率(VMax)、米氏常数(KM)和半抑制浓度(IC50)的函数方程。作者进一步测量了脂质体重构的复合物I在一系列底物和抑制剂浓度下的反应速率,通过拟合上述模型明确了的从结构数据所提出作用机理的正确性。
浙江大学周龙研究员、周如鸿教授、加州大学戴维斯分校James A. Letts教授、浙江大学张汕研究员、附属邵逸夫医院周建仓主任为本文通讯作者。周龙研究员主要从事线粒体氧化磷酸化复合物结构机制与靶向药理研究,现招聘结构生物学、生物化学等方向博士后1-2名。



