在不断变化的环境中,动物必须能够持续适应温度变化,这是维持生理功能稳定、确保生存与繁衍的基本前提。例如,温度显著影响动物的代谢率,也直接影响动物的生长、发育和繁殖。温度对动物生理和行为的影响是复杂而深远的,因此,理解这种影响最初是如何发生的,即生命体首先如何感受到温度的分子机制有着显著的科学意义。
瞬时受体电位(TRP)离子通道是人体内主要的温度感受器。2021 年诺贝尔生理学或医学奖授予了 TRPV1 和 TRPM8 离子通道的发现者。这两种“温度感受离子通道”(thermoTRP channels)的鉴定揭示了温度刺激如何被转化为神经信号的分子基础。然而,这一奖项所表彰的工作主要解决了“哪些蛋白质参与温度感知”这一问题。迄今为止,科学界仍未能回答一个更深层次的问题——这些离子通道蛋白质在物理层面上究竟如何“感受”温度变化,即温度变化如何作用在离子通道蛋白上,引发离子通道构象变化与开放,从而介导离子的跨膜流动与细胞电信号转导。
对这一关键科学问题的解答不仅关系到我们对温度感受机制的根本理解,也将为消除靶向TRP通道的镇痛药物的改变体温的副作用提供理论基础。此前,浙江大学基础医学院生物物理学系杨帆团队围绕着温度感受的分子机制,系统地研究了TRPV1的热激活与热失活过程中的构象变化(PNAS,2010; Nature Communications, 2019),多个物种TRPM8的冷敏感性差异机制(PNAS,2020),发现了新型热感受器离子通道BRTNaC1(PNAS,2023)以及BRTNaC1的热激活中的构象变化(Nature Structural & Molecular Biology, 2025)。
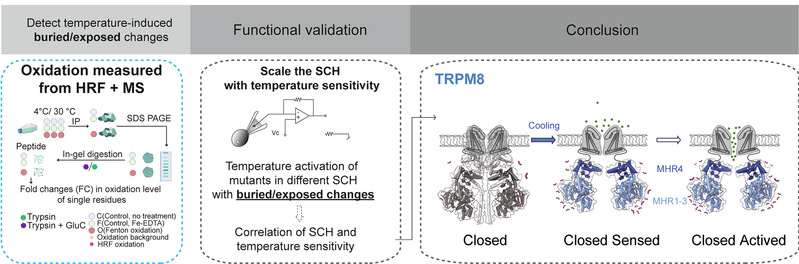
2025年11月15日,杨帆团队与西湖大学朱怡研究员、郭天南研究员、东北林业大学杨仕隆教授合作,在国际学术期刊 EMBO Reports发表题为Rational tuning of temperature sensitivity of the TRPM8 channel的研究论文,首次从“水分子-蛋白质互作”这一物理的角度,揭示了冷觉离子通道 TRPM8 感受低温的关键机制,并通过基因编辑在小鼠体内验证了这一机制。

冷觉“开关”的分子秘密
TRPM8通道是哺乳动物体内的“冷觉开关”,当温度下降或受到薄荷醇刺激时,它会被激活,向神经系统传递“冷”的信号。然而,科学保存家们一直未能明确其对温度变化的感知原理。
杨帆研究员基于该团队先前的研究(PNAS,2020),提出TRPM8通道感受温度的物理本质是水-蛋白相互作用,即在低温时,水分子的热运动减弱,一旦TRPM8通道某些疏水性氨基酸侧链暴露于水环境,围绕的水分子笼(Hydration shell)将更加稳定,从而稳定特定状态的蛋白质构象,激活该通道。
为了验证该机制,杨帆/郭天南/朱怡研究团队采用羟基自由基示踪-质谱分析技术(HRF-MS),首次在对活细胞上TRPM8通道的冷激活过程中,系统识别出了一组发生侧链包埋/暴露构象变化的氨基酸残基簇。这些残基在冷却时从蛋白质内部转向暴露于溶液中,显示出明显的结构重排。
理性调控冷敏感性
在HRF-MS发现的氨基酸残基簇中,通过设计改变侧链疏水性(SCH)的点突变,研究人员能够精确调节TRPM8的温度敏感性。其中,最显著影响冷敏感性的突变集中在TRPM8胞内区的MHR1-3结构域,例如在W137位点引入改变SCH的点突变,可以实现在保持TRPM8通道对薄荷醇的敏感性的同时,几乎消除其冷敏感性。进一步实验表明,单独分离的MHR1-3结构域蛋白质在低温下也会发生明显的构象变化,进一步提示这一结构域是温度感知的核心。这一发现也得到了此前杨仕隆教授团队通过分析不同物种的TRPM8通道的冷感受功能演化得出的结论的支持。
从分子到动物:冷觉“关闭”的小鼠
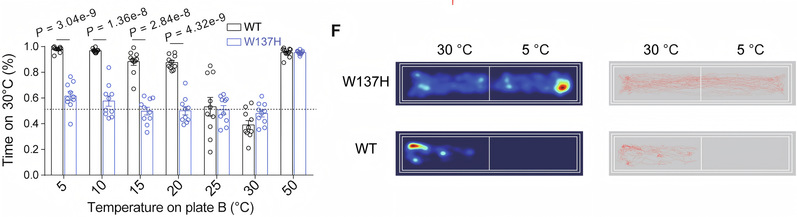
基于上述发现,研究团队在小鼠中通过CRISPR基因编辑技术引入一个关键点突变(W137H),该突变在膜片钳电生理实验中表现出极大减弱的冷敏感性。因此,TRPM8-W137H小鼠对冷刺激几乎无反应,表现出“冷觉缺失”现象,从在体水平验证了该分子机制的正确性。
本研究首次从物理机制层面揭示了TRPM8对温度的感受机制,为理解动物冷觉提供了关键线索,也为开发通过靶向TRP通道治疗冷痛敏感、神经病理性疼痛等疾病的创新药物提供了方向。“我们找到了TRPM8上的‘温度感受器’,这让我们能真正理解冷觉的分子基础。”论文通讯作者杨帆研究员表示,“未来,我们希望进一步探索其他温度感受通道是否遵循类似的物理原理。”



