Ⅰ型干扰素(Interferon,IFN)的合成是细胞对抗病毒等病原体的关键免疫应答,而过量的Ⅰ型干扰素产生会造成紊乱性炎症以及组织损伤。目前如何及时终止Ⅰ型干扰素转录的调控机制尚不完全清楚。
2025年8月29日,浙江大学基础医学院陈玮/浙江大学附属第二医院眼科中心韩伟团队在Nature Immunology杂志上发表题为E3 ligase RAD18 targets phosphorylated IRF3 to terminate IFNB1 transcription的研究论文。该工作首次揭示了调控p-IRF3转录活性的核心E3泛素连接酶RAD18。RAD18作为有效的“制动器”阻断IRF3驱动IFNB1的转录活性,进而负性调节抗病毒固有免疫。

研究人员发现p-IRF3二聚体通过自噬体-溶酶体途径降解。通过基于液相色谱-质谱联用(LC-MS/MS)的非标记定量(Label free)技术筛选出p-IRF3的特异性E3泛素连接酶RAD18,RAD18能促进p-IRF3发生强烈的泛素化和自噬途径降解。
RAD18 选择性识别并结合位于IFNB启动子上的p-IRF3,提示RAD18可能参与p-IRF3转录活性的调控。CHIP-PCR结果证实RAD18 过表达加速p-IRF3从IFNB启动子上解离,RAD18敲除则导致p-IRF3持续滞留在IFNB启动子上并促进IFNβ大量合成。而其他已报道的、作用于IRF3的E3泛素连接酶(TRIM21、TRIM26、RBCK1、UBE3C等)不能直接调控p-IRF3的转录活性。基于RAD18 在p-IRF3的Lys193位点加上多聚泛素化链,IRF3-K193R突变体则持续结合在IFNB启动子上,不能发生后续的转运出细胞核以及进入自噬体降解环节。以上结果证实RAD18通过介导位于IFNB启动子上的p-IRF3发生泛素化修饰,而选择性终止p-IRF3的转录激活作用。
体内实验结果表明 Rad18fl/fl Lysm-cre 小鼠由于IFNβ过量产生而能够抵抗致命性水泡性口炎病毒感染。在感染 H1N1 病毒的人巨噬细胞或来自活动性系统性红斑狼疮患者的单核细胞中,RAD18 蛋白水平与磷酸化IRF3 以及 IFNB1 mRNA 水平呈负相关。因此,RAD18 可作为终止 IRF3 驱动 IFNB1 转录的关键蛋白,并可能成为 RNA 病毒感染或自身免疫性疾病的潜在治疗靶点。
基于以上研究结果,提出RAD18调控p-IRF3转录活性的工作模式(“brake”模式):① 当RIG-I信号通路被激活后,胞浆内的IRF3蛋白被磷酸化并形成二聚体;② p-IRF3二聚体进入细胞核内,并结合到IFNB启动子上驱动IFNβ基因的转录;③ RAD18选择性识别位于IFNB启动子上p-IRF3二聚体,并在p-IRF3的Lys193位点加上K63型多聚泛素化链;④ 泛素化的p-IRF3从IFNB转录复合体中解离出来并转运到细胞核外,从而终止IFNβ基因转录;⑤ 胞浆内泛素化的p-IRF3二聚体结合自噬货物受体OPTN,进而被递送到自噬体进行降解。
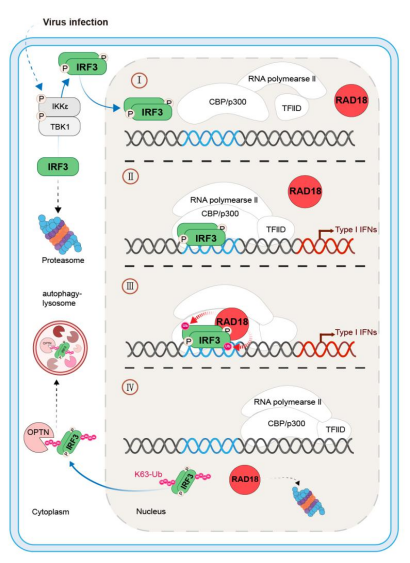
图1 RAD18调控p-IRF3转录活性的工作模式图
浙江大学基础医学院陈玮副教授、浙江大学附属第二医院韩伟教授为本文通讯作者,蔡依廷博士、郑家琦博士、赵琳琳硕士和王雪硕士为本文共同第一作者。该文章的发表受到了国家自然科学基金和浙江省自然科学基金的支持。



